Date: August 2016
Auteur : Dylan Daniel, PhD, directeur du développement scientifique
Le myélome multiple, une affection maligne des lymphocytes B du plasma, est la deuxième affection hématologique maligne la plus courante aux États-Unis. Les cellules myélomateuses malignes s'accumulent dans la moelle osseuse et finissent par remplacer les cellules souches hématopoïétiques normales, ce qui entraîne peu à peu une leucopénie. La chimiothérapie et les inhibiteurs du protéasome sont les standards de traitement de première ligne, souvent suivis d'une transplantation autologue de cellules souches. Les rechutes sont fréquentes avec ces stratégies de traitement1, et la recherche de thérapies ciblées et d'immunothérapies innovantes est très active.
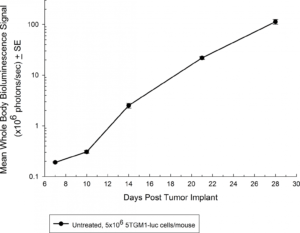
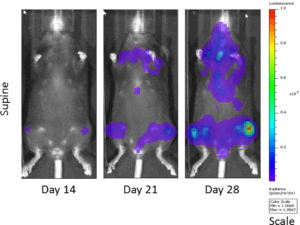
Fig. 1 : cinétique de croissance de 5TGM1-luc chez des souris C57BL/KaLwRij immunocompétentes par BLI
Le modèle de myélome multiple 5TGM1 est apparu spontanément chez des souris C57BL/KaLwRij âgées, et a été propagé par passage sérié chez des souris syngéniques avant l'établissement d'une lignée cellulaire. Our 5TGM1 line has been luciferase-enabled to permit monitoring of growth in orthotopic sites such as the bone marrow by bioluminescent imaging (BLI). L'implantation intraveineuse de 5TGM1-luc chez des souris C57BL/KaLwRij syngéniques entraîne une croissance progressive des cellules, comme le montre la BLI (figure 1), avec un signal évident dans les os longs (moelle) et d'autres sites disséminés, dont le poumon, le foie, la rate, la colonne vertébrale et le cerveau (figure 2). Les cellules 5TGM1-luc se développeront également dans une souche immunodéficiente, la NIH-III Nude, ou BNX, souris offrant un délai plus rapide pour l'évaluation de la charge tumorale dans l'os.
Les inhibiteurs de protéasome sont également devenus des standards de traitement du myélome multiple. Chez la souris NIH-III, à la dose et au régime testés, le modèle 5TGM1-luc ne réagit absolument pas au carfilzomib (figure 3a) d'après l'évaluation par BLI du corps entier ; cependant, dans le cadre syngénique, le modèle 5TGM1-luc montre une tendance au retard de la croissance des tumeurs (figure 3b) qui pourrait être idéal pour des approches combinées.
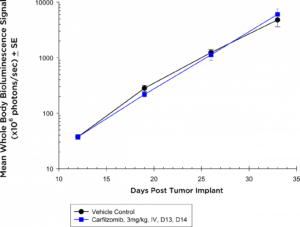
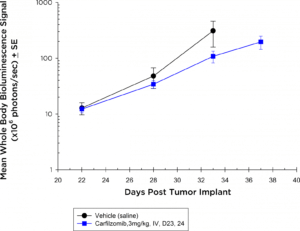
Fig. 3a : effets antitumoraux du Carfilzomib sur la maladie 5TGM1-luc disséminée chez des souris NIH-III Nude
Fig. 3b : effets antitumoraux du Carfilzomib sur la maladie 5TGM1-luc disséminée chez des souris C57BL/KaLwRij
Dans ces études, bien que nous n'ayons pas observé d'activité significative avec l'analyse de la charge tumorale du corps entier, la flexibilité de l'analyse BLI et/ou ex vivo de la charge tumorale dans la moelle osseuse par cytométrie en flux pourrait nous permettre d'affiner notre analyse à des sites anatomiques spécifiques dans de futures études qui pourraient révéler des avantages thérapeutiques. Plusieurs essais cliniques sont en cours, qui testent des inhibiteurs du verrou immunitaire et d'autres agents immuno-oncologiques dans le myélome multiple. Les anticorps anti-PD-12 et anti-CD1373 sont actifs dans le modèle 5TGM1 ce qui suggère qu'il s'agit d'un modèle valide pour tester des agents novateurs en immuno-oncologie.
Références
1Naymagon et al., J Hematol Oncol. (2016) 9: 52.
2Paiva et al., Leukemia (2015) 29: 2110–2113.
3Murillo et al., Clin. Cancer Res. (2008) 14: 6895-6906.
Connexion
Entamons le dialogue
Nous contacter