Author: Sumithra Urs, PhD | Sr. Scientist, Scientific Development
Date: December 2019
Les cancers de la peau comprennent des carcinomes de toutes les couches de la peau, les plus communs étant le carcinome basocellulaire (CBC) et le carcinome à cellules squameuses (CCS). Les cancers de la peau à mélanome et non-mélanome (carcinome à cellules de Merkel, sarcome de Kaposi, lymphome cutané et autres sarcomes) sont bien moins communs. Parmi tous les types de cancer de la peau, le mélanome est une forme grave de cancer de la peau qui commence dans les mélanocytes, les cellules productrices de mélanine dérivées de la crête neurale, situées dans la couche inférieure (la couche basale) de l'épiderme. Si le CBC et le CEC malins sont rarement métastatiques, le mélanome malin, moins courant, est en revanche très agressif et se propage rapidement à d'autres parties du corps. Les mélanomes se présentent sous de nombreuses formes, tailles et couleurs différentes, avec un ensemble complet de signes d'avertissement[1].
Le mélanome est curable, lorsqu'il est détecté et traité précocement, avec un taux de survie à cinq ans estimé à 98 % chez les patients américains[2]. Une fois que le mélanome devient envahissant dans la peau ou d'autres parties du corps, il est plus difficile à traiter et peut être fatal. Les estimations de l'American Cancer Society concernant le mélanome aux États-Unis pour 2019 sont d'environ 192 310 nouveaux mélanomes diagnostiqués dont 96 480 cas seront invasifs, et environ 7 230 personnes devraient mourir de mélanome. Les taux de mélanome ont augmenté rapidement au cours des dernières décennies, et le mélanome est l'un des cancers les plus fréquents chez les jeunes adultes (en particulier les jeunes femmes). La couleur claire de la peau est un facteur de risque majeur pour le mélanome, qui est 20 fois plus fréquent chez les blancs que chez les Afro-Américains, bien qu'aucune couleur de peau n'immunise contre ce cancer. Le risque pour chaque personne peut être influencé par plusieurs facteurs, notamment l'exposition au soleil, les rayons UV, les grains de beauté, les cancers antérieurs, les facteurs génétiques et familiaux.
Les options de traitement dépendent du stade de la maladie, de la localisation de la tumeur et de l'état de santé général du patient. Elles comprennent l'ablation chirurgicale du mélanome, l'immunothérapie, la thérapie ciblée, la chimiothérapie et la radiothérapie. Les thérapies à agent unique fréquemment utilisées ciblent les mutations du gène B-RAF, du gène C-KIT et d'autres gènes anormaux. En outre, des agents de chimiothérapie tels que la dacarbazine, le témozolomide, le nab-paclitaxel, le cisplatine et le carboplatine peuvent tous être utilisés. Des essais cliniques avec des agents d'immunothérapie comme l'IL-2, l'ipilimumab (inhibiteur CTLA-4), et le pembrolizumab et le nivolumab (inhibiteurs PD-1) sont en cours et recrutent activement des patients. Ces médicaments immunomodulateurs sont également testés dans le cadre de combinaisons ainsi que dans des approches néoadjuvantes. En outre, des vaccins contre le mélanome, des vaccins BCG contre les mélanomes de stade III et des virus oncolytiques (T-VEC) sont en cours d'essai[3]. Les nouvelles options thérapeutiques visent à améliorer la qualité de vie et à augmenter le taux de survie des patients atteints de mélanome avancé.
Le modèle murin de mélanome B16 est le modèle de mélanome métastatique le plus fréquemment utilisé pour les études précliniques. We have established the syngeneic B16-F10 model to evaluate responses to immuno-oncology agents and support development of novel therapeutics. La lignée cellulaire B16-F10 a été générée en tant que 10e sous-clone de passage en série de la lignée tumorale mère B16 chez les souris C57BL/6 [4]. In vitro, ces cellules se développent en une population adhérente prenant une morphologie épithéliale. In vivo, l'implantation intradermique de cellules B16-F10 chez les souris C57BL/6 entraîne une croissance agressive des tumeurs. Nos études de croissance montrent une cinétique de croissance efficace après une série d'inocula avec un temps de doublement d'environ 2 à 3 jours (Fig. 1). Les animaux témoins restent à l'étude pendant 20 à 25 jours avant d'atteindre le critère d'euthanasie, avec une charge tumorale excessive. Il en résulte un modèle qui peut offrir une fenêtre de dosage allant jusqu'à deux semaines pour les agents de test afin de susciter leur activité antitumorale. Bien que le modèle lui-même n'entraîne pas de réduction du poids corporel, la croûte tumorale et les ulcérations sont des symptômes cliniques courants associés à la croissance sous-cutanée et intradermique des tumeurs B16-F10.
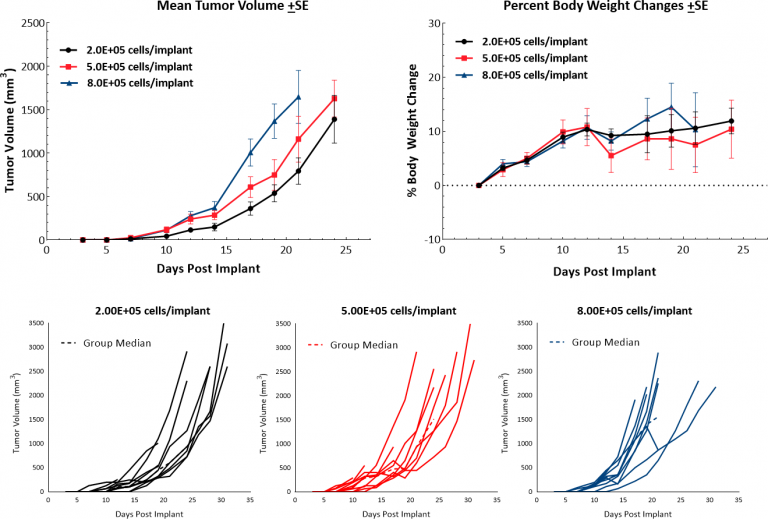
Fig. 1 : Cinétique de croissance et changement de poids corporel après implant intradermique de B16-F10 chez des souris C57BL/6.
Profil immunitaire de la tumeur B16-F10
Baseline immune profiling of B16-F10 tumor infiltrates was determined by flow cytometry on 5 untreated tumors (300-500mm3) and analyzed using the CompLeukocyteTM package. The immune cell infiltration in the tumor microenvironment, represented a percent of CD45+ cells, showed a distinct immune cell population dominated mostly by undefined CD11b+ myeloid cells characteristic to this tumor model (Fig 2). Les TAM M2 (19 %), G-MDSC (15 %) et M-MDSC (11 %) étaient représentées dans des proportions relativement importantes, tandis que les populations de M1 TAM (1,4 %) et de cellules dendritiques (4 %) étaient peu représentées. La population lymphoïde était principalement composée de cellules B (7,3 %) et NK (4 %) avec une infiltration minimale de lymphocytes T dans les tumeurs. Le profil immunitaire global suggère un modèle non immunogénique.
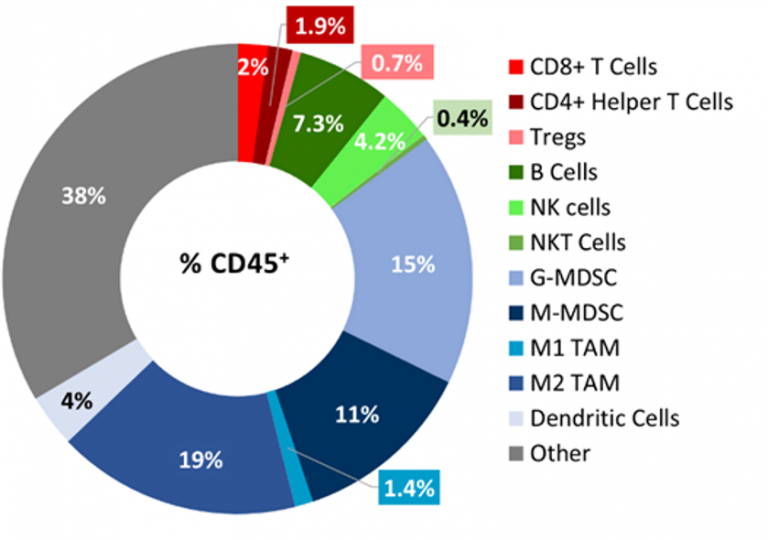
Fig. 2 : Immunophénotypage d'infiltrats de cellules immunitaires dans la tumeur dans le modèle B16-F10.
Réponse de B16-F10 à la thérapie
Modulateurs immunitaires :
We have investigated a number of immune modulatory antibodies in this model. Commencer le traitement lorsque les tumeurs ont atteint ~90 mm3 avec les inhibiteurs de point de contrôle anti-mPD-1 ou anti-mPD-L1 n'a produit aucune réponse dans les tumeurs B16-F10 sous-cutanées (Fig. 3A). De même, débuter le traitement aux anti-mCTLA-4 ou aux anti-mLAG-3 dès quatre jours après l'implantation n'a produit aucune réponse (Fig. 3A). Enfin, nous n'avons constaté aucune activité antitumorale lorsque les tumeurs B16-F10 ont été traitées avec le récepteur costimulateur de la famille des récepteurs TNF CD137 (Fig. 3B). Compte tenu du microenvironnement immunosuppresseur des tumeurs B16-F10 naïves, il n'est pas surprenant que les modulateurs immunitaires à agent unique provoquent une réponse limitée/absente. Cette absence de réponse suggère un modèle immunologique de tumeur froide, comme cela a été signalé pour B16-F10.
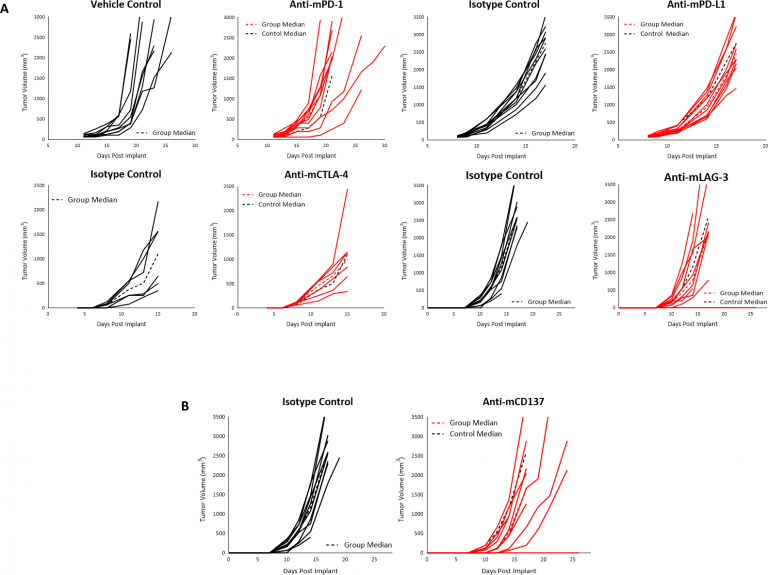
Fig. 3 : Réponse des tumeurs B16-F10 après traitement par des inhibiteurs de point de contrôle (A), ou anti-mCD137 (B), chez des souris C57BL/6.
Radiations :
La radiothérapie (RT) est utilisée dans les cas de mélanome où les patients ne sont pas de bons candidats pour la chirurgie ou refusent le traitement chirurgical. Nous avons évalué la sensibilité des tumeurs sous-cutanées B16-F10 à l'irradiation focalisée à dose unique délivrée par la plateforme de recherche sur le rayonnement des petits animaux (SARRP) de Xstrahl. Les traitements par irradiation de 10, 15 ou 20 Gy ont montré une activité antitumorale chez au moins 50 % des animaux, ce qui a entraîné un retard de croissance des tumeurs de 5.9, 14 ou 10,5 jours pour les radiothérapies à 10, 15 et 20 Gy respectivement, indiquant que le modèle de mélanome B16-F10 est sensible aux rayons (Fig. 4). Cependant, même le traitement à la plus forte dose testée n'a pas entraîné de régression significative ni de survivants sans tumeur. Ainsi, l'utilisation de la radiothérapie focale avec la SARRP dans le cadre préclinique pourrait être utile pour évaluer les approches combinées visant à imiter les voies de développement clinique qui incluent la radiothérapie.
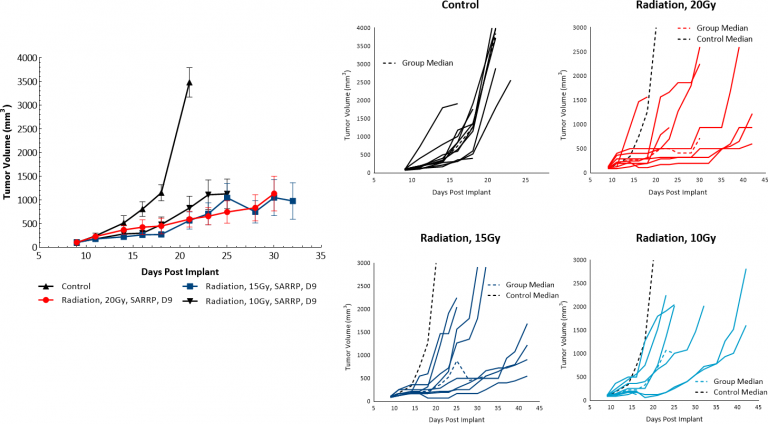
Fig. 4 : Réponse des tumeurs B16-F10 à l'irradiation focale chez des souris C57BL/6.
Les options de traitement pour les patients atteints de mélanome utilisant des approches combinées avec des agents immunomodulateurs et la chimiothérapie ou la radiothérapie sont des voies à explorer pour améliorer la réponse du patient[5]. En outre, le traitement combiné peut également contribuer à modifier la nature immunologiquement froide de la tumeur vers un microenvironnement tumoral plus réceptif/réactif qui se prêterait mieux à la thérapie. To discuss how the B16-F10 model would be useful in your next immunotherapy study, contact the scientists.
Références
1https://www.skincancer.org/skin-cancer-information/melanoma/melanoma-warning-signs-and-images/.
2SEER Cancer Stat Facts. National Cancer Institute, NIH (https://www.cancer.gov).
3 NCI melanoma clinical trials (https://www.cancer.gov/about-cancer/treatment/clinical-trials/disease/melanoma).
4 Nakamura K et al. Characterization of mouse melanoma cell lines by their mortal malignancy using an experimental metastatic model. Life Sci. 2002 janv. 4;70(7):791-8. DOI : 10,1/s0024-3205(01)01454-0.
5 Schwartz AL et al. Antisense targeting of CD47 enhances human cytotoxic T-cell activity and increases survival of mice bearing B16 melanoma when combined with anti-CTLA4 and tumor irradiation. Cancer Immunol Immunother. 2019 oct. 18. DOI : 10,1/s00262-019-02397-7.
Connexion
Entamons le dialogue
Nous contacter