Date: December 2020
L'avènement de thérapies exploitant l'activité anti-tumorale intrinsèque du système immunitaire contre le cancer représente un changement de paradigme dans les thérapies oncologiques qui a définitivement changé l'avenir de la lutte contre le cancer.
Le cancer colorectal (CCR) occupe une place importante dans l'ensemble des cancers, représentant 10 % de tous les cas de cancer ; plus d'un million de nouveaux cas de CCR ont été observés dans le monde en 2018, entraînant plus d'un demi-million de décès1. Les traitements cliniques comprennent la résection chirurgicale suivie d'une chimiothérapie adjuvante pour le cancer du côlon non métastatique, des thérapies plus ciblées étant employées pour le CCR métastatique2. De récentes études cliniques montrent de bons résultats à l'inhibition des points de contrôle immunitaires dans le traitement des patients atteints de cancer colorectal métastatique non résécable, avec une forte instabilité microsatellitaire (MSI-H), ou avec déficience MMR (dMMR)3. Le bénéfice clinique a été tel que Keytruda (anticorps monoclonal ciblant la protéine du point de contrôle PD-1 humaine) a été approuvé comme thérapie de première ligne pour les patients atteints de CCR répondant à ces trois critères à l'été 20204. Avec cette nouvelle promesse de l'immunothérapie contre le CCR, des modèles précliniques hautement translationnels de la maladie sont nécessaires pour évaluer l'efficacité des nouveaux agents immuno-oncologiques.
Évaluer l'efficacité des thérapies ciblant le système immunitaire nécessite des modèles de tumeurs précliniques dont le système immunitaire est intact et qui peuvent être manipulés par les agents testés. Les modèles de tumeurs syngéniques représentent une stratégie de ce type, dans laquelle des cellules cancéreuses dérivées de souris sont cultivées pour former une tumeur dans la souche de souris immunocompétente d'origine des cellules tumorales. We have extensively used CT26.WT murine colon carcinoma as a subcutaneous tumor model in female Balb/c mice to evaluate the efficacy of immuno-oncology agents - see our previous work in the model spotlights below (additional data available upon request):
- Présentation de CT26 : carcinome du côlon murin
- Affiche : Caractérisation de la prolifération dans plusieurs sous-ensembles de lymphocytes dans le modèle murin de carcinome du colon CT26 par cytométrie en flux multicolore
- Affiche : Analyses immunophénotypiques et transcriptomiques des modèles de tumeurs CT26 et 4T1 après un traitement anti-CTLA-4.
Nous reconnaissons les limites expérimentales et translationnelles des modèles de tumeurs sous-cutanées, qui présentent un microenvironnement tumoral différent de celui des tumeurs sur l'organe d'origine, y compris des profils de cellules immunitaires disparates qui peuvent affecter la réponse à l'immunothérapie5,6. L'implantation de cellules tumorales dans le tissu d'origine, connue sous le nom d'implant tumoral orthotopique, vise à corriger les limites des études sous-cutanées et à améliorer le potentiel de translation du modèle.
Dans la présentation de ce modèle, nous allons fournir des données qui sont la preuve d'un modèle de tumeur murine orthotopique robuste et reproductible utilisant le carcinome du colon CT26.WT, des méthodes chirurgicales fiables pour l'implantation, et validant la réponse à l'inhibition du point de contrôle.
Tous les travaux sur les animaux ont été approuvés par le Comité institutionnel de soins et d'utilisation des animaux du centre et ont été effectués conformément au Guide pour le soin et l'utilisation des animaux de laboratoire dans le cadre d'un programme accrédité par l'AAALAC, avec un critère d'euthanasie humaine prédéterminé pour toutes les études.
Croissance orthotopique des tumeurs CT26.WT-luc
Figure 1. Cinétique de croissance de tumeurs dérivées de CT26.WT-luc implantées de façon orthotopique chez des souris Balb/c
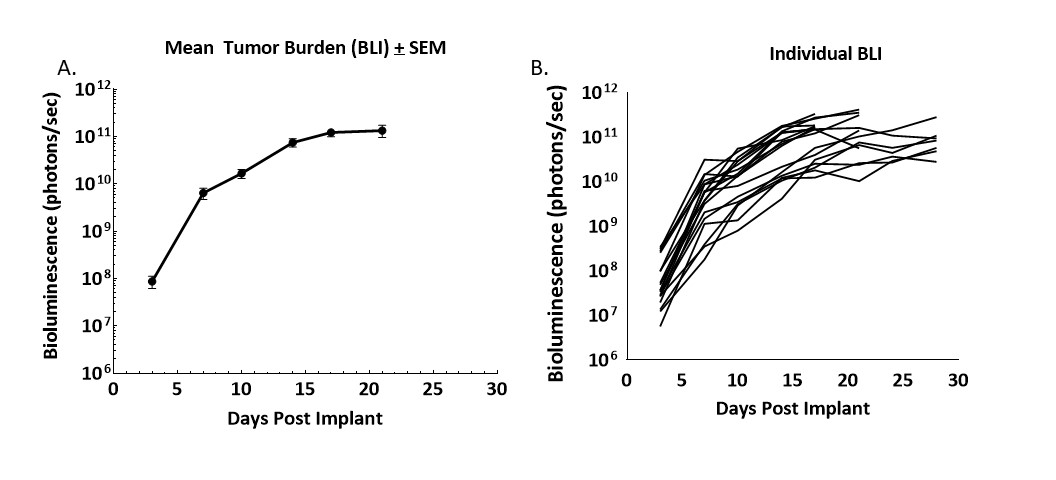
Figure 1 – Suivi longitudinal de la charge tumorale après implant orthotopique de fragments de tumeur CT26.WT-luc par imagerie par bioluminescence de souris 20 Balb/c. La bioluminescence a été utilisée pour la première fois trois jours après implantation. Sont présentées la moyenne du groupe (A) et les valeurs individuelles (B).
La progression de la charge tumorale a été solide, avec des variations minimes. Le taux de greffe de la tumeur était de 95 % d'après la BLI et la nécropsie, aucune régression spontanée n'a été observée. Le temps de doublement (Td) de la tumeur calculé à partir de la BLI a été de 1,5 jours et la durée médiane dans l'étude de 21 jours.
Parmi les observations cliniques couramment associées à la progression de la maladie, notons la distension abdominale due à la croissance de la tumeur et la prise de poids (données non présentées). La nécropsie a révélé de grandes masses primaires sur le cæcum et de petits nodules sur le foie et la paroi abdominale. Les tumeurs primaires sur le colon présentaient une grande intégration vasculaire avec le côlon, ce qui indique un recrutement vasculaire efficace par la tumeur. Nous avons ensuite utilisé ce modèle pour déterminer l'efficacité des agents immuno-oncologiques.
Inhibition des points de contrôle dans le modèle de tumeur CT26.WT-luc orthotopique
Des souris Balb/c naïves ont fait l'objet d'une implantation chirurgicale de fragments de tumeur CT26.WT-luc comme décrit ci-avant. Les animaux ont été triés par BLI trois jours après l'opération et répartis dans des groupes de traitement selon les valeurs obtenues par BLI. Animals were treated by intraperitoneal administration of 10mg/kg isotype control (clone LTF-2), anti-mPD-L1 (clone 10F.9G2), anti-mCTLA-4 (clone 9D9) or anti-mPD-1 (clone RMP1-14) twice weekly for two weeks. Tous les anticorps ont été obtenus auprès de BioXCell ( Lebanon, New Hampshire, États-Unis). Les animaux ont été suivis par des mesures par BLI deux fois par semaine pour la charge tumorale, trois fois par semaine pour le poids, des observations cliniques quotidiennes et des observations de nécropsie terminale.
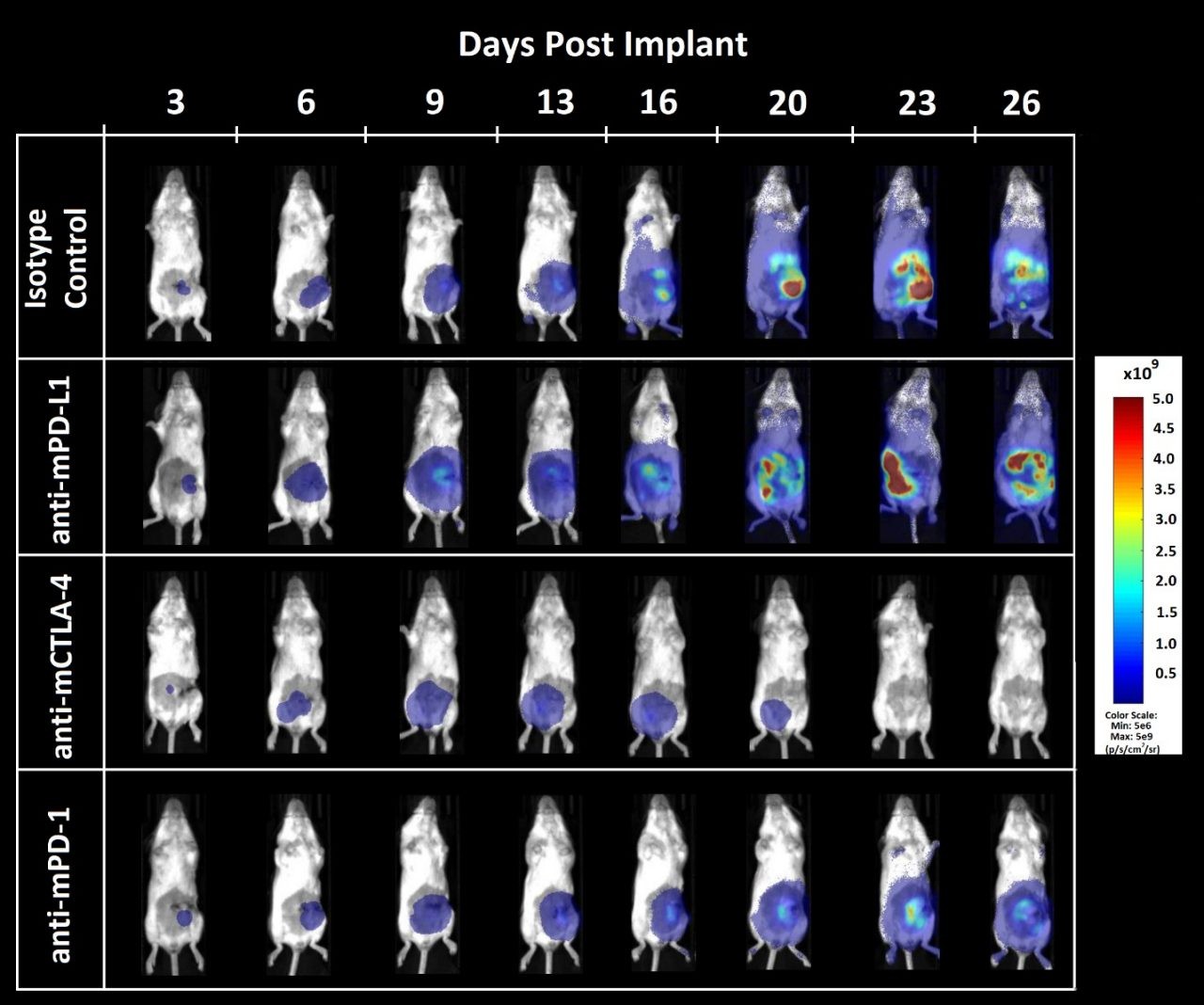
Figure 2 – Réponse des tumeurs CT26.WT-luc à implantation orthotopique aux anticorps inhibiteurs de point de contrôle. Charge tumorale moyenne du groupe évaluée par BLI (A) et valeurs de BLI de chaque animal (B-E) en réponse aux thérapies indiquées.
L'administration de l'anticorps isotype de contrôle n'a pas eu d'effet sur la charge tumorale ou la progression de la maladie (figure 2A, 2B). Le temps de doublement de la tumeur chez les animaux ayant reçu l'isotype de contrôle était de 2,2 jours, et la durée médiane dans l'étude de 28 jours. L'administration d'anti-mPD-L1 (figures 2A, 2C) a permis une régression complète (pas de charge tumorale détectable au-dessus des valeurs de fond de la BLI). Le traitement par anti-mCTLA-4 (figures 2A, 2D) est à l'origine d'un ΔT/ΔC de 0,1 % au jour 23 et de cinq régressions partielles (valeurs de BLI inférieures à la moitié de celle du premier jour de traitement) sans maladie détectable visuellement au moment de la nécropsie. L'administration d'anti-mPD-1 (figure 2A, 2E) n'a pas entraîné de régression ou de survivant sans tumeur.
Figure 3. Imagerie par bioluminescence de la réponse de la tumeur CT26.WT-luc orthotopique à l'inhibition des points de contrôle
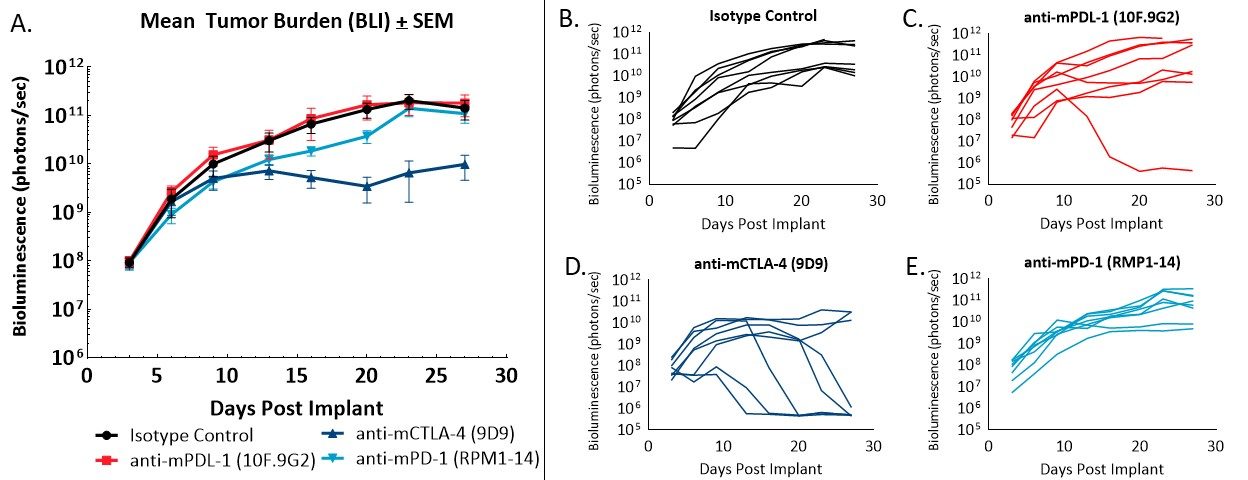
Figure 3 - Imagerie par bioluminescence de tumeurs dérivées de CT26.WT-luc à l'implantation orthotopique sur des souris Balb/c femelles traitées avec des inhibiteurs de point de contrôle immunitaire. Les animaux présentés sont représentatifs de la valeur BLI médiane pour chaque groupe respectif.
La charge tumorale était localisée dans l'abdomen et a augmenté avec le temps (figure 3) comme prévu d'après des expériences de croissance pilotes antérieures (données non présentées). Le traitement par anti-mCTLA-4 a entraîné un retard de début de prise de poids liée à la maladie (données non présentées). L'administration d'anti-mPD-L1 ou d'anti-mCTLA-4 a augmenté la durée de vie par rapport à l'isotype de contrôle de 12,5 et 23,6 jours, respectivement. La nécropsie terminale n'a révélé aucune trace de tumeur ou autre lésion chez 1 des 8 animaux ayant reçu l'anti-mPD-L1, et 5 des 8 animaux ayant reçu l'anti-mCTLA-4.
Les travaux en cours évaluent les différences entre l'implantation sous-cutanée et orthotopique de CT26.WT en ce qui concerne l'infiltration des cellules immunitaires de la tumeur, ses caractéristiques histologiques et sa morphologie, ainsi que l'activation immunologique en réponse au blocage des points de contrôle.
Dans l'ensemble, nous avons démontré que le modèle orthotopique CT26.WT-luc du cancer du côlon fournit une plateforme robuste pour évaluer les agents immuno-oncologiques dans un emplacement d'implantation hautement translationnel.
Contact our scientists to learn more about the CT26.WT-luc, and other murine orthotopic tumor models, and how we can apply these tools to advance your oncology pipeline.
Références
1Bray F, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2018; 68:6, 394-424.
2Kuipers E, et al. Colorectal Cancer. Nat Rev Dis Primers. 2015; 1: 15065.
3Tintelnot J, Stein A. Immunotherapy in colorectal cancer: available clinical evidence, challenges and novel approaches. World J Gastroenterol. 2019; 25:29, 3920-3928.
4Food and Drug Administration. FDA approves first-line immunotherapy for patients with MSI-H/dMMR metastatic colorectal cancer. Communiqué de presse du 29 juin 2020.
5Devaud C, et al. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy. Mol Ther. 2014; 22:1, 18-27.
6Zhao X, Li L, Starr TK, Subramanian S. Tumor location impacts immune response in mouse models of colon cancer. Oncotarget 2017; 8:33, 54775-54787.
7Fiegle E, Doleschel D, et al. Dual CTLA-4 and PDL-1 blockade inhibits tumor growth and liver metastasis in a highly aggressive orthotopic mouse model of colon cancer. Neoplasia 2019; 21:9, 932-944
Connexion
Entamons le dialogue
Nous contacter