Date: February 2021
Successful treatment of breast cancer by immunotherapy continues to be a challenge, but emerging clinical data is encouraging.3 To help enable preclinical research of immunotherapy in breast cancer, we have developed the orthotopic EMT6 syngeneic breast tumor model in 2018.
The EMT6 model was derived from a transplanted hyperplastic alveolar metastatic lung nodule in BALB/c mice.4 As further data was generated with this model, observations of metastatic foci in the lung visible upon gross necropsy occurred in up to 40 % of control mice. As metastasis is common in breast cancer patients, it was important to take advantage of this finding, so a luciferase enabled EMT6 cell line (EMT6-Luc) was generated to monitor thoracic metastasis by bioluminescence imaging (BLI) in vivo. For this project, animal care and use was conducted according to animal welfare regulations in an AAALAC-accredited facility with IACUC protocol review and approval.
Dans cette présentation, nous présentons les données de notre étude d'efficacité initiale avec le modèle EMT6-Luc implanté dans le coussinet adipeux mammaire (CAM), à la fois par mesure au calibre de la tumeur primaire et par BLI de la zone thoracique pour surveiller la progression des métastases. La croissance de la tumeur de contrôle des modèles EMT6 et EMT6-Luc est présentée à la figure 1. Pour les modèles parental et EMT6-Luc, le temps de doublement médian des tumeurs MFP est de 5,5 jours, ce qui laisse une fenêtre thérapeutique de deux à trois semaines pour évaluer l'activité anti-tumorale des agents testés.

Figure 1. Croissance de contrôle individuelle de EMT6 (A) et EMT6-Luc (B) implantées de façon orthotopique (coussinet adipeux mammaire) chez des souris Balb/c femelles.
Pour déterminer la réponse de l'EMT6-Luc au blocage des points de contrôle, les tumeurs EMT6-Luc chez les souris ont été traitées par anti-mPD-1 ou anti-mPD-L1. Les réponses au blocage des points de contrôle ont été modérées par rapport au contrôle (figure 2) et les réponses aux anti-MPD-1 dans l'EMT6-Luc ont été similaires aux données générées avec la lignée parentale (tableau 1). La réponse à l'anti-MPD-L1 semble légèrement améliorée dans l'EMT6-Luc par rapport à la lignée parentale (tableau 1), mais l'impact global de l'ajout de la luciférase en ce qui concerne l'efficacité anti-tumorale dans les conditions testées semble minime.
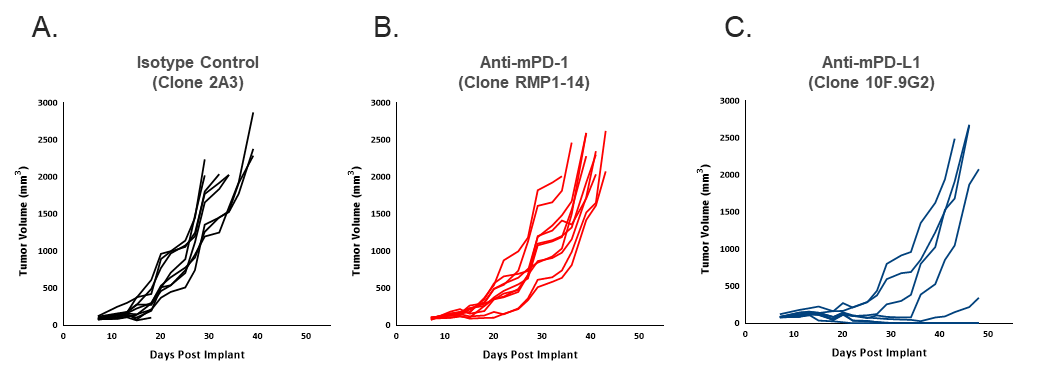
Figure 2. Mesures des volumes de tumeur EMT6-Luc montrant l'efficacité anti-tumorale de l'anti-mPD-1 (B) et de l'anti-mPD-L1 (C) par rapport à l'isotype de contrôle (A). Chaque anticorps a été dosé deux fois par semaine à 10 mg/kg.
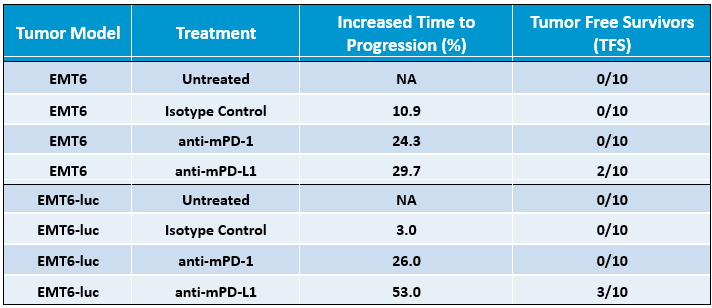
Tableau 1. Différences dans les modèles de tumeur EMT6 et EMT6-Luc de la réponse à l'inhibition des points de contrôle par anti-mPD-1 et anti-mPD-L1. Le critère de l'augmentation du délai de progression est basé sur l'augmentation du nombre de jours, par rapport aux tumeurs non traitées, entre le début du traitement et le jour de la sortie de l'étude de l'animal.
En plus d'évaluer la réponse au traitement par des mesures primaires de la tumeur sur les CAM, la lignée cellulaire activée par la luciférase permet également de suivre le développement des métastases thoraciques en évaluant la localisation du signal BLI in vivo. Le développement du signal thoracique est illustré à la figure 3. Comme prévu, la surveillance par BLI offre une granularité supplémentaire sur le degré de métastase, ainsi que tout retard dans l'implication métastatique avec le traitement des anti-MPD-1 ou anti-MPD-L1. Tous les animaux témoins ont présenté un signal BLI thoracique croissant au cours de l'étude, mais aucun de ces animaux n'a présenté de nodules métastatiques lors de la nécropsie générale (données non présentées). Si une évaluation pathologique est nécessaire pour confirmer l'étiologie de l'augmentation du signal thoracique, les observations historiques de nodules pulmonaires lors de la nécropsie d'animaux non traités suggèrent fortement que l'augmentation du signal est due à des métastases, ce qui souligne la valeur de ce critère. Partant de cette hypothèse, on peut conclure que le traitement par l'anti-mPD-L1 a entraîné un retard dans l'apparition des métastases conforme au retard dans la croissance primaire de la tumeur. Il convient de noter que les métastases dans ce modèle n'entraînent pas un déclin de la santé, car les souris sortent de l'étude pour la charge tumorale primaire avant l'impact des métastases sur la santé.
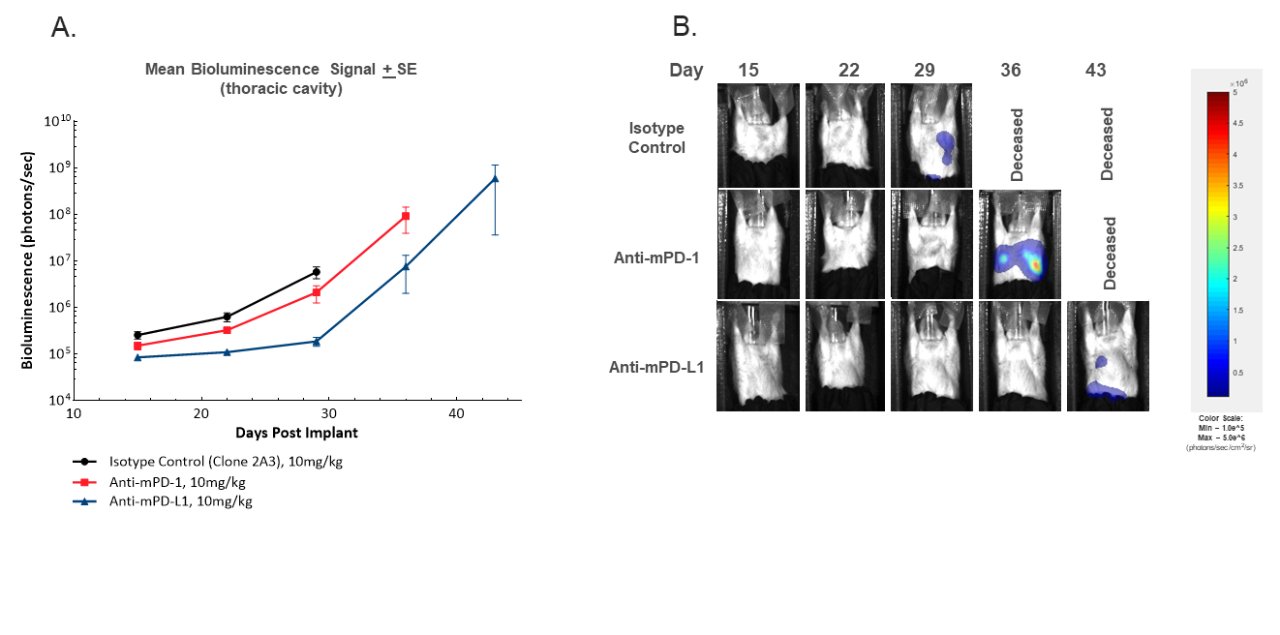
Figure 3. Imagerie BLI in vivo pour suivre l'évolution du signal thoracique au fil du temps par la charge tumorale moyenne dans la région thoracique (A) ou par images BLI représentatives (B).
Lorsque l'on interroge des modèles à des fins d'immuno-oncologie, il est également important de connaître la composition des cellules immunitaires infiltrées dans une tumeur. À cette fin, les tumeurs naïves entre 150 et 550 mm3 ont été examinées à la recherche de lymphocytes T infiltrés et de cellules myéloïdes exprimés en pourcentage du total des cellules CD45+ (figure 4). Le compartiment myéloïde parmi toutes les tumeurs était uniformément réparti entre les macrophages M2, les MDSC monocytaires et les MDSC granulocytaires. L'infiltration macrophagique des M1 était comparativement plus faible que celle d'autres cellules dérivées de myéloïdes et était légèrement plus élevée dans les tumeurs EMT6-Luc que dans les tumeurs EMT6. L'infiltration des cellules CD4+ et CD8+ T cells était minime mais constante dans les tumeurs EMT6 et EMT6-Luc avec une légère élévation des cellules NK dans les tumeurs EMT6-Luc. Cette composition suggère un microenvironnement immunosuppresseur qui pourrait contribuer à expliquer la réponse limitée de la plupart des régimes d'immunothérapie testés.
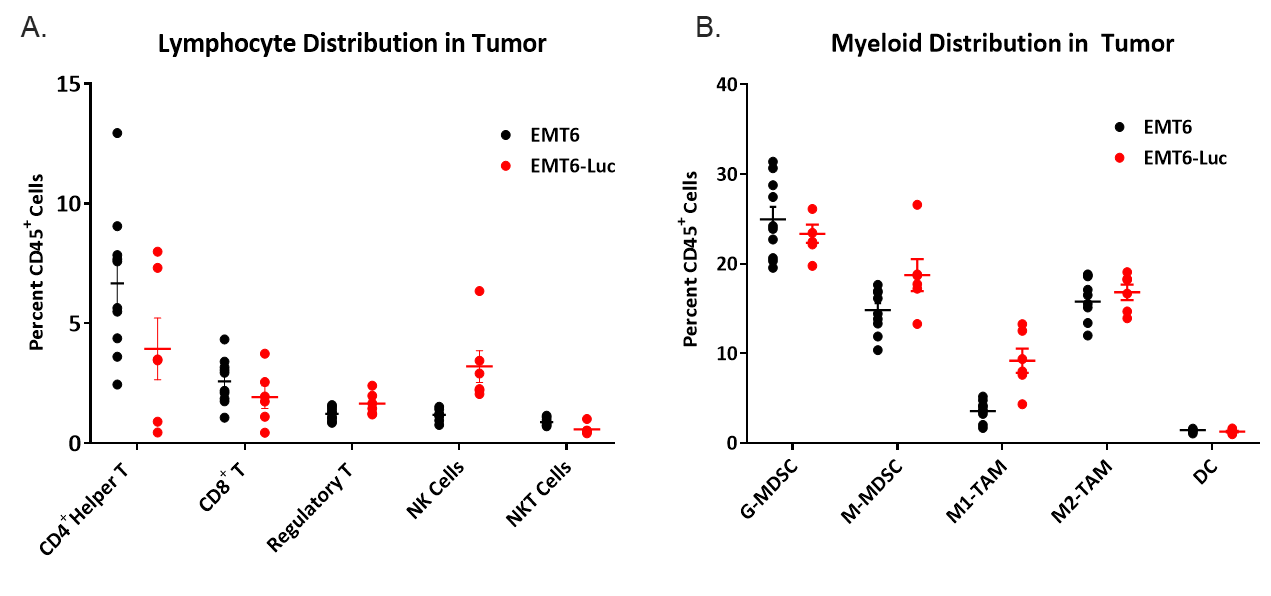
Figure 4. Distribution des cellules immunitaires lymphoïdes (A) et myéloïdes (B) dans les tumeurs EMT6 et EMT6-Luc naïves.
Le modèle de carcinome du sein murin EMT6-Luc a un profil immunitaire favorable qui profite de tout le système immunitaire de la souris et sert d'outil puissant dans l'univers de l'immuno-oncologie. Ces données plaident en faveur de l'utilisation du modèle EMT6-Luc comme modèle d'immuno-oncologie préclinique robuste pour l'évaluation de la croissance des tumeurs primaires ainsi que de la formation de métastases thoraciques à distance.
Please contact us to speak with our scientists about how EMT6-Luc, or one of our other syngeneic models, can be used for your next immuno-oncology study.
Références
1 “American Cancer Society: Cancer Facts & Statistics.” American Cancer Society | Cancer Facts & Statistics, cancerstatisticscenter.cancer.org/?_ga=2.5394928.293340281.1606765768-996476487.1605734560.
2 Howlader N, Noone AM, Krapcho M, Miller D, Brest A, Yu M, Ruhl J, Tatalovich Z, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (eds). SEER Cancer Statistics Review, 1975-2017, National Cancer Institute. Bethesda, MD, https://seer.cancer.gov/csr/1975_2017/, basé sur les données SEER de novembre 2019, publié sur le site SEER, avril 2020.
3Leal JHS and McArthur H. Breast cancer immunotherapy: From biology to current clinical applications. Eur. Med. J., 2020; 5(2): 113-124.
4Rockwell SC, Kallman, RF, Fajardo, LF. Characteristics of a Serially Transplanted Mouse Mammary Tumor and Its Tissue-Culture-Adapted Derivative. J. Natl. Can. Inst., 1972 ; 49(3) : 735-749.
Connexion
Entamons le dialogue
Nous contacter