Auteure : Sumithra Urs, PhD | Scientifique, développement scientifique
Date: October 2018
Hepatocellular carcinoma (HCC) is an aggressive malignancy which has gradually increased in incidence to affect one million people worldwide and is currently the third leading cause of cancer related deaths in the world.[1,2] The prevalence of HCC is highest in Asia and Africa due to high endemicity of hepatitis B and C viruses which strongly predispose to the development of chronic liver disease and subsequent HCC.[1]
In the Western population, hepatitis C, alcoholic cirrhosis, and non-alcoholic steatohepatitis (NASH) are the main underlying causes. Si, pendant les premières phases du CHC, les options de traitement incluent excision chirurgicale, greffe du foie, embolisation chimio/radio, et ablation avec radiofréquence, la norme de soin pour les CHC avancés consiste en des thérapies ciblées (sorafenib et regorafenib), radiation et chimiothérapie (doxorubicin, 5-FU, et cisplatin).[3] De nombreux essais cliniques sont en cours pour traiter les CHC non résécables ou avancés avec des mono-immunothérapies et immunothérapies combinées, des anticorps monoclonaux ou une thérapie virale oncolytique. [1-4] Ces thérapies ont démontré une diminution des tumeurs, et une amélioration de la survie ; cependant, elles ne sont pas curatives avec le résultat du traitement dépendant de conditions préexistantes comme l'hépatite, la cirrhose du foie ou encore le fois gras non alcoolique (FGNA). Le besoin de trouver de meilleures options de traitement est donc de plus en plus important. To evaluate novel therapies in a preclinical platform, Labcorp has established the syngeneic HCC model Hepa 1-6.
Hepa 1-6 est un hépatome murin dérivé de l'hépatome BW7756 qui apparaît spontanément dans les souris C57L/J et qui diffère de la plupart des modèles d'hépatomes disponibles (BNL, A.7R.1, MH-129, MH134 et MH-22A), qui sont des lignées modifiées ou induites chimiquement. Le modèle de tumeur Hepa 1-6 établi chez les souris immunocompétentes représente un modèle cliniquement pertinent pour les tests précliniques dans un contexte d'immunothérapie.
In this model spotlight we present in vivo data on Hepa 1-6 tumor model growth kinetics; along with response to checkpoint inhibitors alone or in combination with focal radiation. Nous avons testé le modèle sur sa souche parente C57L/J (disponibilité limitée aux Laboratoires Jackson, Bar Harbor, Maine) et la souche C57BL/6, plus facile à trouver et histocompatible.
Paramètres de croissance Hepa 1-6
La cinétique de croissance après un implant sous-cutané montre que le modèle s'établit avec succès dans les deux souches de souris (fig. 1). Les tumeurs ont un temps de doublement médian de ~5-6 jours sans modification indésirable du poids (données non présentées). Ce taux de croissance constant permet de disposer d'une fenêtre thérapeutique de trois semaines pour évaluer les réponses antitumorales.
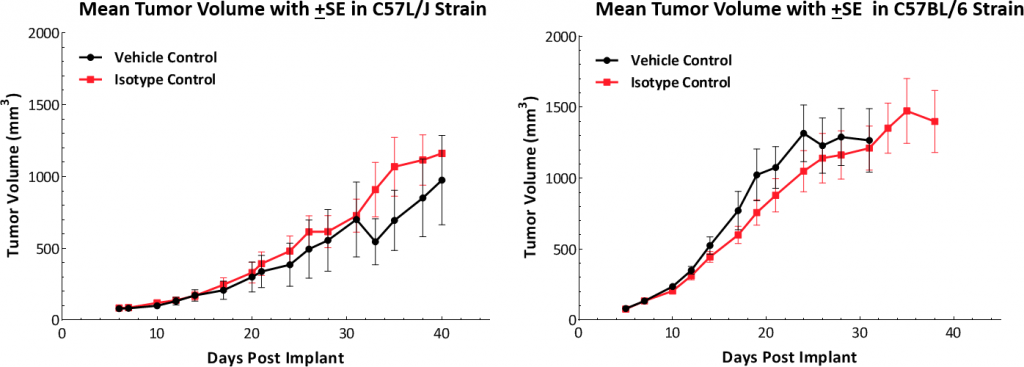
Fig. 1: cinétique de croissance de la tumeur Hepa 1-6 dans les souris C57L/J et C57BL/6.
Profil immunitaire de la tumeur Hepa 1-6
Pour mieux comprendre le profil immunitaire des tumeurs Hepa 1-6, la composition immunitaire de référence a été analysée par cytomérie en flux et est présentée dans la fig. 2. Le profil immunitaire a été établi à partir de cinq tumeurs Hepa 1-6 non traitées développées dans la souche C57L/J pour atteindre un volume de ~750-1000 mm3. Les tumeurs possèdent une population cellulaire CD45+ relativement élevée (pourcentage moyen ~60 %), parmi laquelle les lymphocytes T (lymphocytes T CD8+ lymphocytes T auxiliaires CD4+) étaient modérément représentés (pourcentages moyens respectifs ~11 % et ~6 %). La population myéloïde était principalement représentée par G-MDSC (pourcentage moyen ~30 %) puis par M-MDSC (pourcentage moyen ~11 %). L'infiltration des cellules T CD8+ dans le microenvironnement de la tumeur suggère un modèle de tumeur immunologiquement réactif, ou « chaud ».
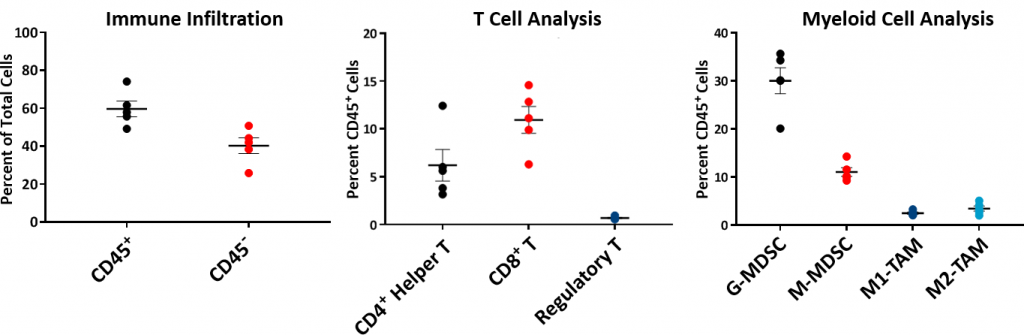
Fig. 2 : profil immunitaire de référence de tumeur Hepa 1-6 dans les souris C57L/J.
Réponse de l'Hepa 1-6 aux inhibiteurs de point de contrôle
La réponse de l'Hepa 1-6 aux agents immunomodulateurs a été évaluée chez des souris C57BL/6 portant une tumeur établie (volume moyen de la tumeur ~100 mm3) traitées avec des anticorps de blocage aux points de contrôle (anti-mPD-1, anti-mPD-L1 et anti-mCTLA-4). Les contrôles, véhicule (PBS) et isotype (Rat IgG2b clone LTF-2), ont montré une cinétique de croissance comparable (fig. 1). Les inhibiteurs de point de contrôle à agent unique anti-MPD-1 et anti-MCTLA-4 ont provoqué une forte réponse conduisant à une régression tumorale complète (CR) et à un taux de survie sans tumeur (TFS) de 100 %. Le traitement anti-mPD-L1 a aussi obtenu une bonne réponse dans un sous-ensemble d'animaux avec CR et taux de TFS de 5/10 (fig. 3). Le traitement par des anticorps inhibiteurs de point de contrôle n'a pas été associé à des changements significatifs du poids par rapport aux animaux témoins (données non présentées). La réponse à l'immunothérapie incite fortement à suivre la piste immunitaire pour les tumeurs Hepa 1-6.
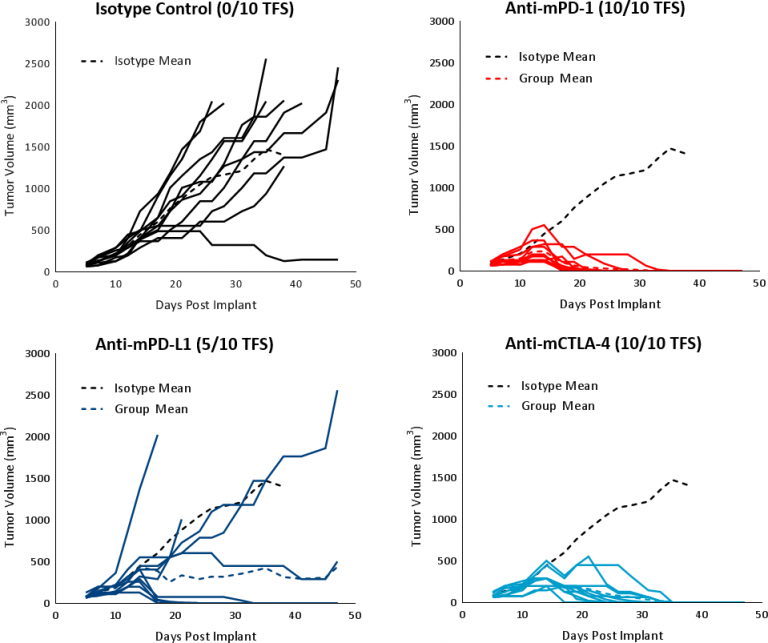
Fig. 3 : réponse de la tumeur Hepa 1-6 aux inhibiteurs de point de contrôle chez la souris C57BL/6.
Réponse aux radiations ciblées
Cliniquement, les patients atteints de CHC non métastatique reçoivent une ou plusieurs thérapies ciblées sur le foie (LDT pour « Liver Directed Therapy ») telles que la radiothérapie (RT) ou la radiothérapie stéréotaxique corporelle (RSC)[5]. La RT peut entraîner un rétrécissement de la tumeur et modifier le microenvironnement de la tumeur en un milieu favorable à sa suppression. Pour tester la réponse des tumeurs Hepa 1-6 à la RT, nous avons utilisé la plateforme de recherche sur les radiations sur les petits animaux (SARRP ; Xstrahl) pour administrer une radiation focale en faisceau dans des zones ciblées. Des doses de radiation ciblée de 5 et 10 Gy ont été testées sur des tumeurs Hepa 1-6 sous-cutanées chez des souris C57BL/6. Le traitement a montré une réponse dépendant de la dose et a entraîné un retard de croissance de la tumeur (TGD pour « tumor growth delay ») >20 jours, et des survivants sans tumeur (2/10 et 8/10, respectivement) (fig. 4). Une dose de 5 Gy a obtenu une réponse modérée en monothérapie avec une durée de vie accrue, et est recommandée pour de futures études d'association.
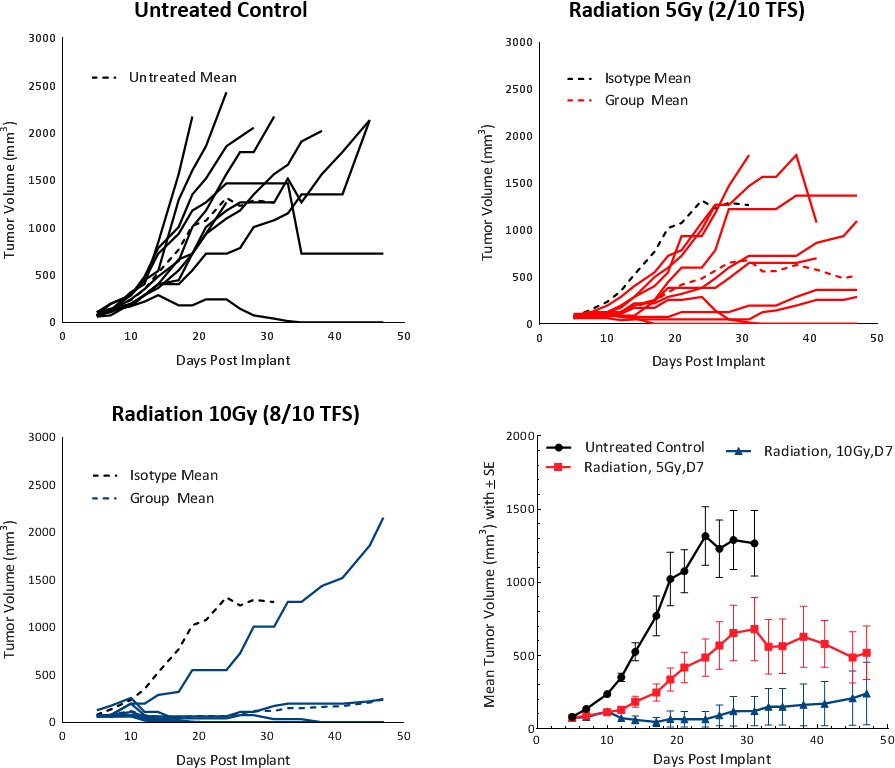
Fig. 4 : réponse de la tumeur Hepa 1-6 à la radiothérapie chez la souris C57BL/6.
Réponse de l'Hepa 1-6 au sorafenib
Le sorafenib, un inhibiteur multityrosine kinase qui bloque l'activité des récepteurs Raf kinase, Src, VEGF et PDGF, utilisé comme traitement de première intention chez les patients atteints de CHC, a été testé sur les tumeurs Hepa 1-6. Le traitement a entraîné un retard de croissance de la tumeur de 25,4 jours et a prolongé la survie globale mais n'est à l'origine d'aucun TFS (fig. 5). Ces résultats sont comparables aux conclusions d'études cliniques qui ont montré une réponse partielle prolongeant la survie globale médiane de 7,9 mois dans le groupe de contrôle à 10,7 mois dans le groupe traité[1].
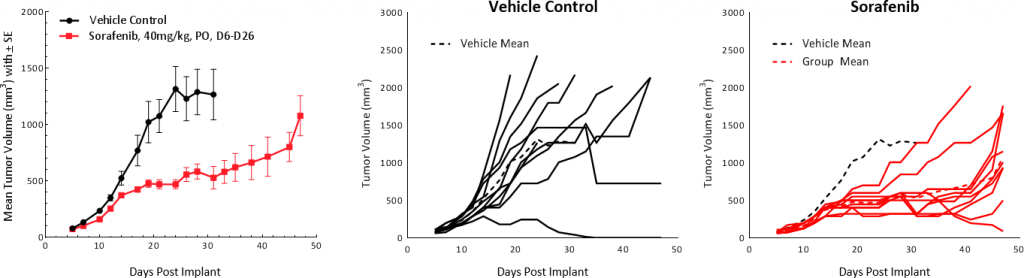
Fig. 5 : réponse de la tumeur Hepa 1-6 au traitement par sorafenib chez la souris C57BL/6.
Ces données préliminaires suggèrent que le modèle Hepa 1-6 du CHC a un profil immunitaire favorable et peut être utilisé comme un modèle préclinique robuste en immuno-oncologie. Nos données sont en faveur de l'utilisation de ce modèle dans l'étude des agents d'immunothérapie en monothérapie ou associé à des radiations, de petites molécules, les soins standard et d'autres thérapies innovantes.
Please contact us to speak with our scientists about how Hepa 1-6 can be used for your next immuno-oncology study.
Références
[1]Medavaram, S. et Zhang Y., 2018. Emerging therapies in advanced hepatocellular carcinoma. Exp Hematol Oncol 7:17.
[2]Llovet J.M., Montal R., Sia D. et Finn R.S., 2018. Molecular therapies and precision medicine for hepatocellular carcinoma. Nat Rev Clin Oncol. doi: 10,1/s41571-018-0073-4. [Epub avant impression] PMID:30061739.
[3]Pinter M. et Peck-Radosvljevic M. 2018. Article de synthèse : systemic treatment of hepatocellular carcinoma. 2018. Aliment Pharmacol Thera, juil. 23. doi: 10,11/apt.14913. [Epub avant impression] Article de revue. PMID: 30039640.
[4]Waidmann O. 2018. Recent developments with immunotherapy for hepatocellular carcinoma. Expert Opin Biol Ther. Aug;18(8):905-910.
Connexion
Entamons le dialogue
Nous contacter