Date: May 2017
On estime qu'en 2017, il y aura environ 30 000 nouveaux cas diagnostiqués et environ 13 000 décès de patients atteints de myélome multiple. Toutefois, il s'agit d'un type de cancer relativement peu fréquent, avec un risque de 1 pour 143 (0,7 %) sur la durée de vie. Le risque d'être diagnostiqué avec un myélome multiple augmente avec l'âge, la majorité des personnes étant diagnostiquées à partir de 65 ans. Les hommes sont légèrement plus susceptibles de développer un myélome multiple que les femmes et les Afro-Américains sont deux fois plus susceptibles de développer ce type de cancer. Cependant, le plus grand facteur de risque du myélome multiple est une maladie des cellules plasmatiques. Les patients atteints de gammapathie monoclonale de signification indéterminée (GMSI) ou de plasmocytome solitaire développeront à terme un myélome multiple.
Le myélome multiple est une malignité clonale des lymphocytes B caractérisée par l'accumulation dans la moelle osseuse de plasmocytes différenciés en phase terminale et produisant des anticorps. Les mutations génétiques au sein des cellules myélomateuses et leur interaction avec diverses cytokines et facteurs de croissance contribuent au caractère invasif de la maladie et à une résistance accrue aux médicaments. Les patients sont généralement asymptomatiques jusqu'à un stade très avancé de la maladie. Une fois la maladie détectée, la localisation dans les os, en particulier la colonne vertébrale, est courante. Actuellement, la thérapie de référence est une combinaison de doxorubicine et de dexaméthasone avec du bortézomib. L'ajout de bortézomib améliore le taux de réponse global de près de 50 %.1
Une lignée cellulaire couramment utilisée pour évaluer de nouvelles thérapies pour le myélome multiple est la lignée MM.1S. La MM.1S provient d'une femme afro-américaine de 42 ans et a été identifié comme exprimant le CD25, le CD38, le CD52 et le CD59. It also expresses the glucocorticoid receptor and is dexamethasone sensitive.2 In an effort to more effectively monitor in vivo disease progression, we transfected the MM.1S line with luciferase (MM.1S-pMMP-LucNeo). Grâce à l'imagerie par bioluminescence (BLI), nous pouvons suivre la progression de la maladie diffusée dans le temps et trouver une croissance reproductible in vivo chez la souris (figures 1 et 2).
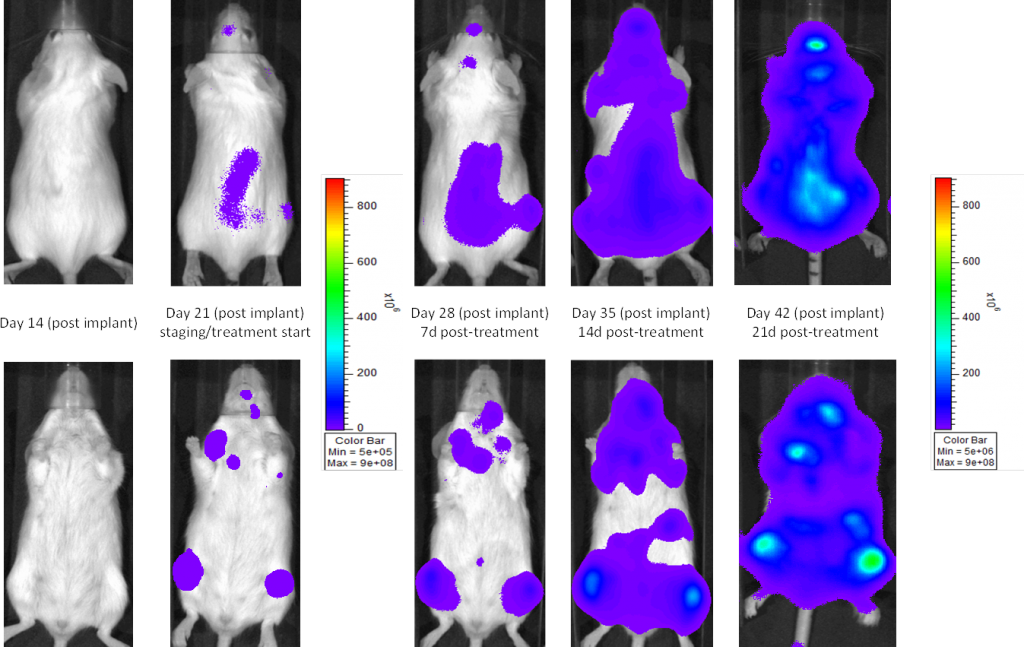
![Fig. [#0]} : Myélome multiple humain MM.1S-pMMP-LucNeo chez la souris NSG : images représentatives de l'évolution de la maladie - Contrôle](https://biopharma.labcorp.com/industry-solutions/by-therapeutic-area/oncology/preclinical/tumor-spotlights/mm-1s-a-model-for-multiple-myeloma1/_jcr_content/root/responsivegrid_left/image_copy.coreimg.png/1670865696325/1578076567078.png)
Fig. [#0]} : Myélome multiple humain MM.1S-pMMP-LucNeo chez la souris NSG : images représentatives de l'évolution de la maladie - Contrôle
Signal BLI de la charge tumorale totale moyenne
Chez la souris beige SCID, le temps médian de doublement du volume de la tumeur est de ~2 jours (figure 3), et le temps médian jusqu'au point final de morbidité/mortalité est de 35-45 jours. Pour optimiser davantage le modèle MM.1S-pMMP-LucNeo, nous avons caractérisé la croissance de la souche de souris NSG qui montre un début de maladie plus agressif (sept jours après l'implantation contre 15 jours chez les souris SCID). Chez les souris NSG, le temps de doublement du volume de la tumeur est de ~1,8 jours (figure 4) et le temps médian jusqu'au point final est de ~21 jours, soit environ la moitié du temps de survie global observé chez la souris beige SCID.
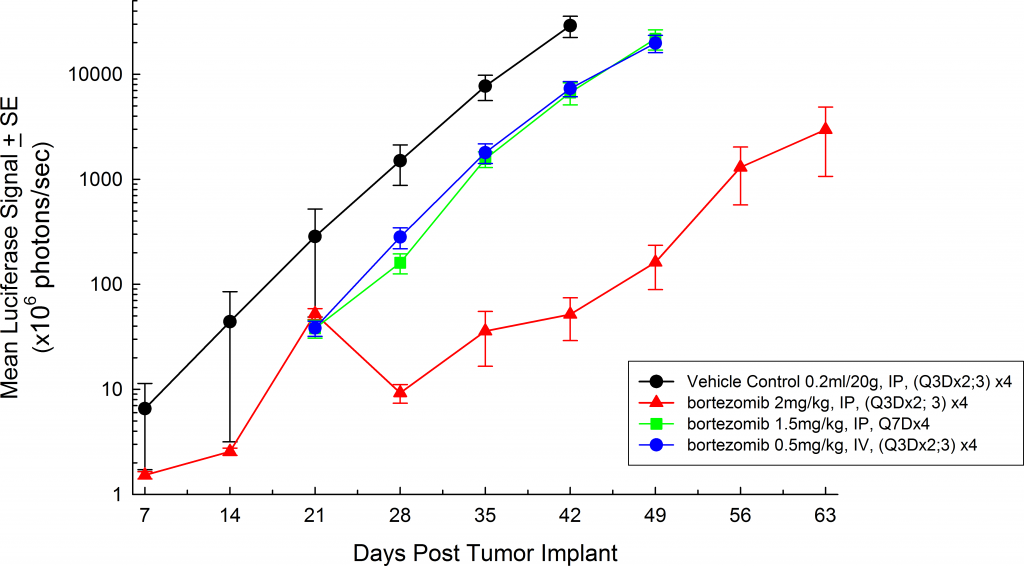
![Fig. [#0]} : myélome multiple humain MM.1S-pMMP-LucNeo chez la souris NSG : signal BLI de la charge tumorale totale moyenne](https://biopharma.labcorp.com/industry-solutions/by-therapeutic-area/oncology/preclinical/tumor-spotlights/mm-1s-a-model-for-multiple-myeloma1/_jcr_content/root/responsivegrid_left/image_copy_copy.coreimg.png/1670865692209/1578076788228.png)
Fig. 3 : myélome multiple humain MM.1S-pMMP-LucNeo chez la souris SCID Beige : signal BLI de la charge tumorale totale moyenne
Fig. [#0]} : myélome multiple humain MM.1S-pMMP-LucNeo chez la souris NSG : signal BLI de la charge tumorale totale moyenne
Pourcentage moyen de variation de poids
Dans toutes les souches de souris que nous avons étudiées, les animaux sont relativement asymptomatiques pendant toute la durée de l'étude et ne commencent à présenter des symptômes qu'à un stade avancé de la maladie (figures 5 et 6) ; de la même manière que la maladie se manifeste chez l'homme. Les signes cliniques courants, à un stade avancé, chez les souris comprennent la léthargie et la paralysie. Les BLI sur ces animaux montrent la localisation du signal dans la colonne vertébrale, les os longs et la mandibule. Le bortézomib en monothérapie (Velcade®) a un effet limité sur la progression de la maladie dans ce modèle. Ce résultat est similaire aux données observées en clinique qui suggèrent que la réponse au traitement peut être améliorée lorsque le bortézomib est administré en combinaison avec d'autres agents. Prenant en compte la reproductibilité du modèle ainsi que les aspects translationnels de la progression et de la réponse de la maladie, le modèle MM.1S fournit la plate-forme pour évaluer les nouveaux traitements à agent unique ainsi que les combinaisons de médicaments.
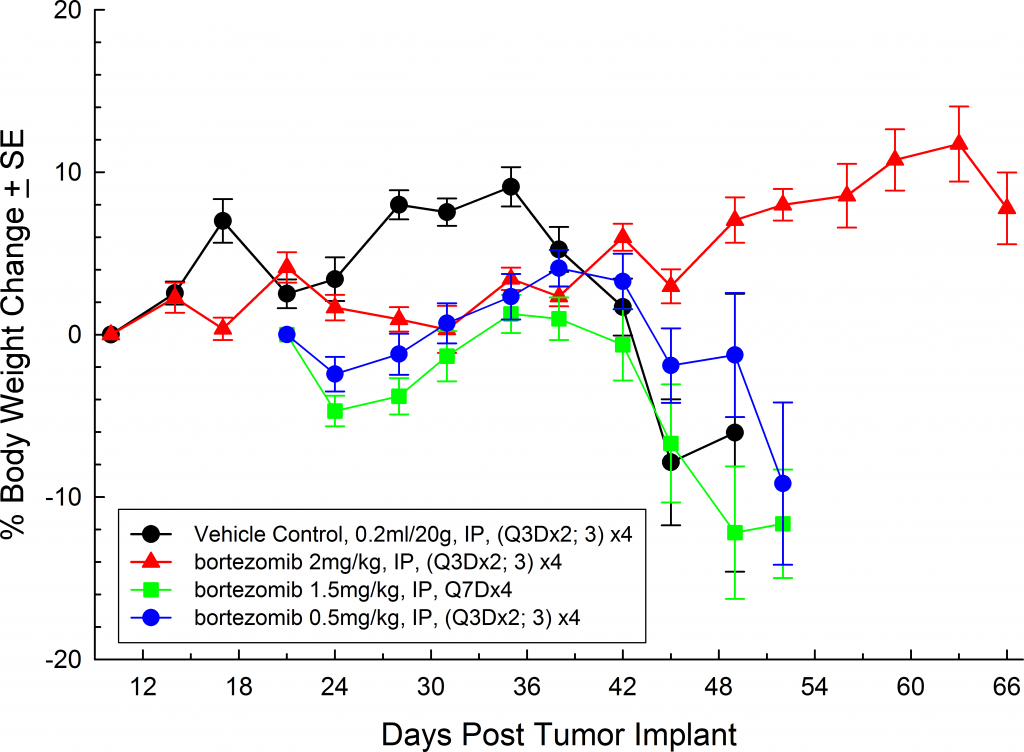
![Fig. [#0]} : myélome multiple humain MM.1S-pMMP-LucNeo chez la souris NSG : pourcentage moyen de variation de poids](https://biopharma.labcorp.com/industry-solutions/by-therapeutic-area/oncology/preclinical/tumor-spotlights/mm-1s-a-model-for-multiple-myeloma1/_jcr_content/root/responsivegrid_left/image_copy_copy_copy_702550069.coreimg.png/1670865734710/1578076951652.png)
Fig. 5: MM.1S-pMMP-LucNeo human multiple myeloma in SCID Beige mice: Mean % Body Weight ChangeFig. 6: MM.1S-pMMP-LucNeo human multiple myeloma in NSG mice: Mean % Body Weight Change
Références
Connexion
Entamons le dialogue
Nous contacter