Auteure : Erin Trachet | Conseillère scientifique, oncologie/directrice, développement de propositions
Date: March 2018
Comme nous l'avons présenté dans la description du modèle du mois dernier, le cancer du poumon est une maladie dévastatrice, première cause de décès par cancer aux États-Unis et dans le monde. 1 Le monde de la recherche continue de chercher de nouveaux modèles qui aideront la recherche sur le cancer du poumon. L'ATCC (une banque de données de cellules très utilisée) a actuellement plus de 100 lignées de cellules de cancer du poumon dérivées de l'humain.
Étant donné la fréquence du cancer du poumon, il existe de nombreuses possibilités d'acquérir et de caractériser de nouvelles lignées humaines. Les scientifiques savent désormais très bien distinguer les mutations qui favorisent une prolifération accrue de celles qui empêchent la croissance de la tumeur. Cette information est essentielle pour développer de nouvelles thérapies contre le cancer du poumon.
Chez Labcorp, nous poursuivons les recherches sur les lignées cellulaires, nouvelles ou non conventionnelles, et nous avons conscience de leur importance pour la recherche de nos clients. Dans cette description de modèle, nous allons présenter quelques-unes de ces lignées et expliquer comment notre expertise constitue une ressource précieuse pour nos clients qui cherchent à développer de futurs traitements.
NCI-H3122
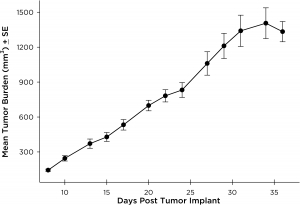
NCI-H3122 a été dérivé en 1981 d'un carcinome bronchioalvéolaire primaire du poumon d'un homme de 52 ans, prélevé avant le traitement. Cette lignée cellulaire abrite la protéine de fusion EML4-ALK (protéine de type protéine associée aux microtubules de l'échinoderme 4 fusionnée au gène de la kinase du lymphome anaplasique) et a récemment été identifiée chez ~7 % des patients japonais atteints de CPNPC (cancer du poumon non à petites cellules) et ~4,5 % de tous les cas de CPNPC. Le gène ALK est une cible d'intérêt en raison de ses capacités oncogènes. Comme NCI-H3122 contient l'EML4-ALK et est très sensible aux inhibiteurs ALK à agent unique, il semble que sa survie soit médiée par une voie plus dépendante de l'ALK2. En tant que modèle préclinique, cette lignée cellulaire serait adaptée au criblage de nouveaux inhibiteurs ALK qui ne dépendent pas de l'EGFR, ou d'autres voies impliquées dans le CPNPC. The model has been developed as a subcutaneous (SC) implant; however, we have also implanted this line intracranially to mimic the clinical setting where advanced NSCLC metastasizes to the brain. La croissance tumorale sous-cutanée est fiable avec une variabilité réduite d'un animal à l'autre. Le temps de doublement du volume de la tumeur en implantation sous-cutanée est de ~7 jours et les souris atteignent généralement une taille d'évaluation de ~750 mm3 en environ 25 jours. Les premières données concernant l'implantation intracrânienne de NCI-H3122 sont encourageantes. Dans une étude pilote, nous avons constaté un taux de prise de 100 % et un temps de doublement du volume de la tumeur, selon l'évaluation volumétrique, de ~7 jours, ce qui correspond au taux de croissance SC (voir figures 1 et 2). Comme dans beaucoup de modèles intracrâniens, la morbidité (perte de poids corporel et observation clinique générale) est utilisée pour définir la survie globale. Pour cette ligne cellulaire, le jour médian du décès est ~35 jours (voir les figures 2, 3 et 4).
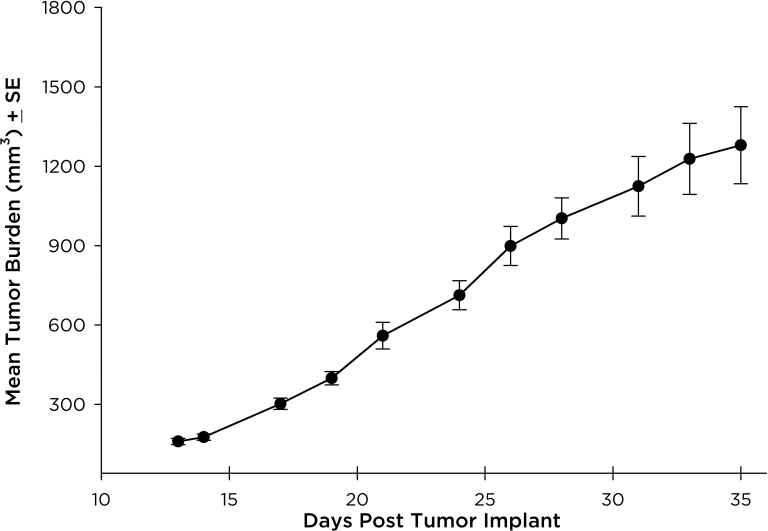
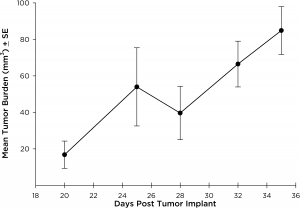
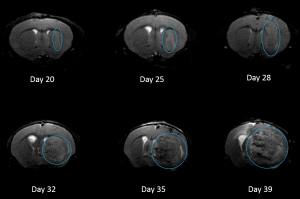
Fig. 1 : charge tumorale moyenne de NCI-H3122 sous-cutanée
Fig. 2 : croissance tumorale moyenne de NCI-H3122 en implantation intracrânienne par IRM
Fig. 3 : modification du poids corporel en pourcentage après implantation intracrânienne de NCI-H3122
Fig. 4 : images représentatives H3122-3160
NCI-H1703
NCI-H1703 est dérivé d'un carcinome épidermoïde pulmonaire de stade 1 d'un fumeur caucasien de 54 ans. Cette lignée cellulaire présente un intérêt pour le monde de la recherche en raison des niveaux élevés d'amplification du récepteur du facteur de croissance dérivé des plaquettes α (PDGFRα). NCI-H1703 est l'un des rares modèles de CPNPC avec ce profil d'expression, et sensible au sunitinib in vitro. Sur le plan clinique, les patients souffrant d'un cancer du poumon qui expriment PDGFRα sont associés à une biologie tumorale plus agressive et à un pronostic plus défavorable3. Par conséquent, ce modèle est adapté à l'évaluation de nouvelles cibles angiogéniques telles que le facteur de croissance vasculaire endothéliale ainsi que de nouvelles cibles PDGFRα indépendantes des voies de prolifération de la surface cellulaire. The model is most commonly utilized following subcutaneous (SC) implant, however, we have also transfected this line with luciferase to allow for bioluminescence imaging to monitor disease progression following direct implant into the lung. La croissance tumorale est fiable après un implant SC ou pulmonaire orthotopique (OT). Dans les deux sites d'implantation, la variabilité entre animaux est minime, le volume de la tumeur double tous les 6 jours (SC) et 11 jours (OT). Si le taux de croissance de la tumeur dépend du site d'implantation, les souris atteignent normalement la taille d'évaluation (~750 mm3 ou 1E+09 p/s) en environ 30 jours après l'implantation (voir figures 5 [SC], 6, 7 et 8 [OT]).
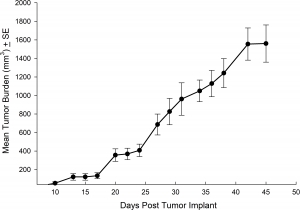
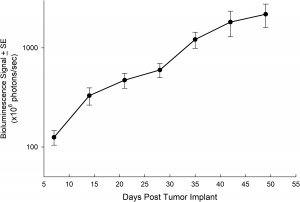
Fig. 5 : charge tumorale moyenne de NCI-1703 en implantation sous-cutanée
Fig. 6 : charge tumorale moyenne de NCI-1703 en implantation orthotopique
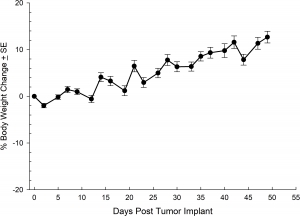
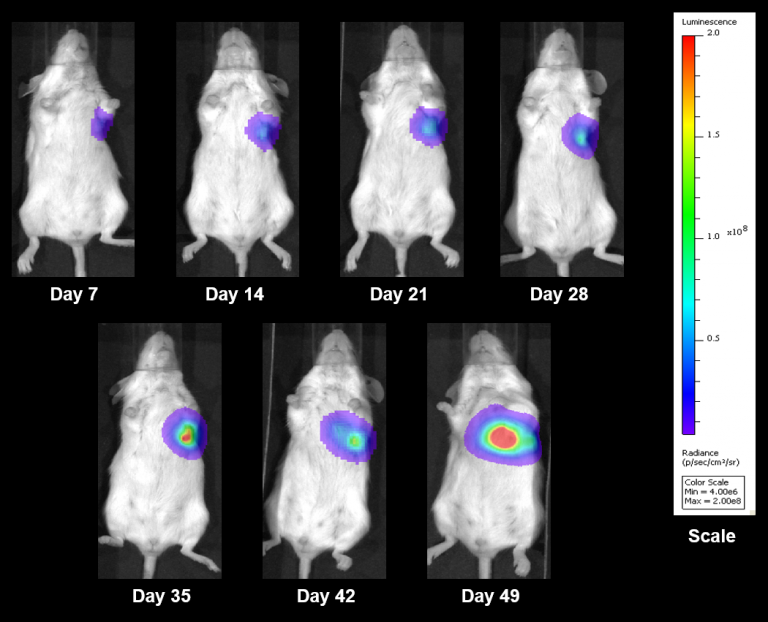
Fig. 7 : modification du poids corporel en pourcentage après implantation orthotopique de NCI-1703
Fig. 8 : images représentatives par BLI de NCI-1703 en implantation orthotopique
PC-9
PC-9 a été isolé chez un patient masculin atteint d'un adénocarcinome pulmonaire en 1989. Il a été souligné que PC-9 est très sensible au gefitinib et aux autres inhibiteurs de la tyrosine kinase de l'EGFR. Cependant, il a été démontré qu'une exposition prolongée des cellules de PC-9 aux inhibiteurs EGFR peut entraîner l'acquisition de la mutation T790M et d'une lignée cellulaire résistante. Ce modèle serait précieux pour l'évaluation des inhibiteurs EGFR de prochaine génération ou éventuellement pour la création d'une version résistante afin d'évaluer des approches thérapeutiques alternatives. We have developed PC-9 as a subcutaneous model that demonstrates reliable growth with minimal animal-to-animal variability. Le temps de doublement du volume de la tumeur est de ~7 jours et les tumeurs atteignent normalement la taille d'évaluation (~750 mm3) environ 28 jours après implantation (voir figures 9).
Please contact us if you are interested in discussing any of our human NSCLC models.
Découvrez notre liste complète de modèles de xénogreffes humaines, dont fait partie notre vaste banque de modèles du CPNPC.
Fig. 9 : charge tumorale moyenne de PC-9 en implantation sous-cutanée
Références
2EML4-ALK fusion gene and efficacy of an ALK kinase inhibitor in lung cancer. Jussi P. Koivunen, Craig Mermel, Kreshnik Zejnullahu, Carly Murphy, Eugene Lifshits,6 Alison J. Holmes, Hwan Geun Choi, Jhingook Kim, Derek Chiang, Roman Thomas, Jinseon Lee,9,10 William G. Richards, David J. Sugarbaker, Christopher Ducko, Neal Lindeman, J. Paul Marcoux, Jeffrey A. Engelman, Nathanael S. Gray, Charles Lee, Matthew Meyerson et Pasi A. Jänne. Clin Cancer Res. 2008 Jul 1; 14(13): 4275-4283.
3Stromal Platelet-Derived Growth Factor Receptor α (PDGFRα) Provides a Therapeutic Target Independent of Tumor Cell PDGFRα Expression in Lung Cancer Xenografts. David E. Gerber, Puja Gupta, Michael T. Dellinger, Jason E. Toombs, Michael Peyton, Inga Duignan, Jennifer Malaby, Timothy Bailey, Colleen Burns, Rolf A. Brekken et Nick Loizos Molecular Cancer Therapeutics 10,12/1535-7163.MCT-12-0431 Publié en novembre 2012.
Connexion
Entamons le dialogue
Nous contacter