Auteure : Sumithra Urs, PhD | Scientifique, développement scientifique
Date: June 2019
Pancreatic cancer is the ninth most commonly diagnosed cancer and ranks as one of the deadliest with the lowest 5-year survival rate of 5-8 %.[1,2,3] This year alone, the American Cancer Society estimates that 56 770 people will be diagnosed with the disease of which more than 45 750 people may not survive. Pancreatic ductal adenocarcinoma (PDAC) being the most prevalent and aggressive form of exocrine pancreatic cancer accounts for ~90 % of cases with mortality equaling incidence.[4,5]
Au moment du diagnostic, une vaste majorité de patients atteints d'un ACP souffrent d'une maladie localement avancée, non résécable ou métastatique. La progression silencieuse de la maladie et l'apparition de symptômes spécifiques seulement à des stades avancés rendent la détection précoce très difficile et contribuent aux faibles taux de survie. Les options de traitement pour les patients résécables comprennent la chirurgie suivie d'une chimiothérapie systémique de première ligne (gemcitabine, FOLFIRINOX, paclitaxel) ou d'une chimioradiothérapie combinée. For locally advanced, unresectable patients, the regimen includes multi-agent chemotherapy (5-FU, oxaliplatin, irinotecan) or chemoradiotherapy.[6] As these treatments have offered limited benefits to pancreatic cancer patients, newer options like immunotherapy drugs are now being tested in clinical trials.
Les ACP se caractérisent par la présence d'un stroma fibreux, une faible charge mutationnelle, l'absence d'infiltration de cellules T CD8+ et la présence de populations de cellules myéloïdes immunosuppressives, tout ceci correspondant aux caractéristiques typiques des tumeurs non immunogènes[7]. Les approches actuelles visant à améliorer la réponse au traitement se concentrent sur l'augmentation du trafic de lymphocytes T vers les tumeurs en utilisant des agents comme la radiothérapie (RT). Dans la plupart des tumeurs solides, la radiothérapie seule peut activer le système immunitaire pour déclencher une réponse immunitaire antitumorale après la mort de cellules due à la cytotoxicité et la libération de signaux immunostimulants. Cependant, chez les patients atteints d'ACP, le résultat de la RT à forte dose seule ou en combinaison avec des agents de chimiothérapie reste généralement insatisfaisant[8] et les essais cliniques avec des agents d'immunothérapie à agent unique indiquent de faibles taux de réponse (à 1-2 %)[9]. Au moins 21 essais cliniques ouverts étudient actuellement la combinaison de la RT avec d'autres agents immunostimulants, ce qui pourrait être une voie prometteuse pour le traitement de l'ACP et mérite de plus amples recherches[10]. Dans le même ordre d'idées, dans la plateforme préclinique, nous évaluons des thérapies simples et combinées en utilisant le modèle Pan02 d'ACP murin. Pan02 est un modèle d'adénocarcinome de grade III reconnu, développé par induction chimique avec du 3-MCA (3-méthylcholanthrène) chez des souris C57BL/6 mâles [11]. Dans cette description du modèle, nous présentons des données in vivo sur la cinétique de croissance du modèle de tumeur Pan02, la réponse aux anticorps immunomodulateurs, l'irradiation focale et la combinaison de la RT avec des agents immunomodulateurs testés sur la souche de souris C57BL/6 syngénique.
Paramètres de croissance de Pan02
L'implantation sous-cutanée de Pan02 permet l'établissement de tumeurs qui ont un temps de doublement médian de 4 à 5 jours et les souris restent à l'étude pendant environ 30 jours après l'implantation (fig. 1) sans perte de poids (données non présentées). La cinétique de croissance offre une fenêtre thérapeutique de trois semaines pour évaluer les réponses antitumorales dans ce modèle.

L'analyse d'immunophénotypage des tumeurs Pan02 par cytométrie en flux a confirmé la faible infiltration des cellules lymphoïdes dans les tumeurs (fig. 2). While CD8+ et CD4+ helper T cells constituted only 1,6 % and 1 % of the CD45+ population, respectively, the immunosuppressive myeloid cell populations were present in abundance. Les M-MDSC et les TAM M1 et M2 étaient les sous-populations cellulaires dominantes. Ce profil immunitaire des tumeurs est caractéristique du modèle de tumeur « froid » ou non-immunogénique, comme ce que l'on observe chez les patients avec ACP.

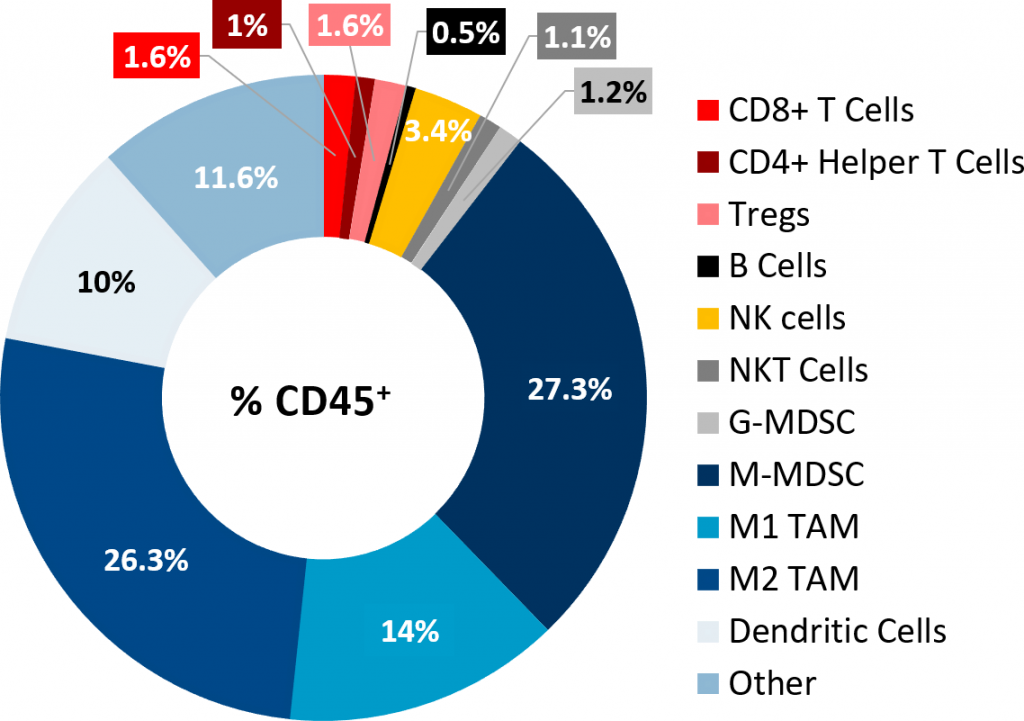
Fig. 2 : profil immunitaire des tumeurs Pan02 sous-cutanées.
Réponse de Pan02 aux traitements par un agent unique
Le traitement par un agent unique des souris porteuses de tumeurs Pan02, par la gemcitabine (100 mg/kg, Q3Dx4), l'une des chimiothérapies les plus couramment utilisées chez les patients atteints d'un cancer du pancréas, a été bien toléré et a produit un retard de croissance tumorale (TGD pour « tumor growth delay ») statistiquement significatif (fig. 3).

Fig. 3 : réponse de Pan02 à la gemcitabine.
Suite à l'étude clinique des immunothérapies contre l'ACP, nous avons entrepris d'évaluer la réactivité de notre modèle Pan02 à une variété d'anticorps immunomodulateurs (fig. 4). Cependant, conformément au profil immunosuppresseur des tumeurs Pan02, ce modèle a présenté, comme on pouvait s'y attendre, une réponse minime ou nulle aux inhibiteurs de point de contrôle anti-mPD-1, anti-mPD-L1 et anti-mCTLA-4, et aux anticorps costimulateurs anti-mCD137 et anti-mOX40. Tous les anticorps ont été dosés deux fois par semaine à 10 mg/kg pour un total de 4 doses (fig. 4).

Fig. 4 : réponse de Pan02 aux anticorps immunomodulateurs.
Réponse de Pan02 à l'irradiation et aux traitements combinés
La radiothérapie est fréquemment administrée aux patients souffrant d'ACP. Chez notre modèle murin, nous avons utilisé la plate-forme de recherche pour la radiothérapie sur les petits animaux (SARRP ; Xstrahl) pour délivrer une dose unique d'irradiation focale (5 Gy ou 10 Gy) directement sur la tumeur et nous avons observé un retard de croissance de la tumeur dépendant de la dose de 9,5 et 22 jours, respectivement, par rapport au témoin non traité (fig. 5).
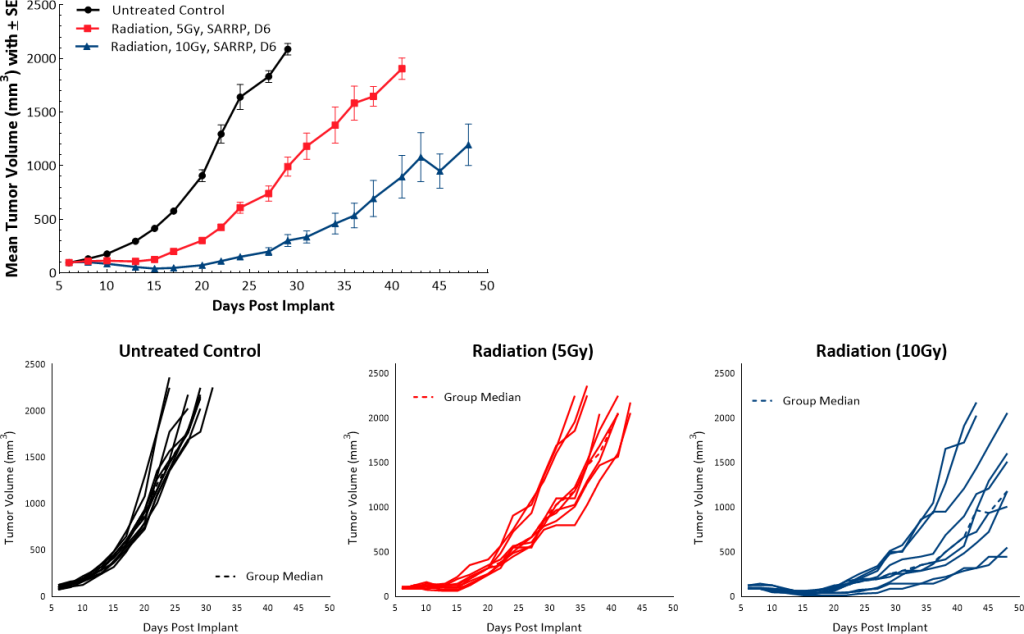
Fig. 5 : réponse de Pan02 à l'irradiation focalisée.
Afin d'étudier les effets anti-tumoraux de la RT en combinaison avec des inhibiteurs de points de contrôle, une dose unique de 5 Gy a été utilisée avec des anticorps anti-MPD-1 ou anti-MPD-L1. Les groupes témoins non traités et isotypes ont montré des taux de croissance similaires et le traitement avec des inhibiteurs de point de contrôle à agent unique anti-mPD-1 et anti-mPD-L1 n'a pas provoqué de réponse anti-tumorale. Alors qu'une dose unique de RT à 5 Gy a entraîné un TGD de 9,5 jours par rapport au témoin non traité, la combinaison avec des inhibiteurs de point de contrôle n'a pas contribué de manière significative à l'amélioration de la réponse anti-tumorale. La RT avec anti-MPD-1 ou avec anti-PD-L1 a entraîné un TGD de 13 et 11,2 jours, respectivement (fig. 6).
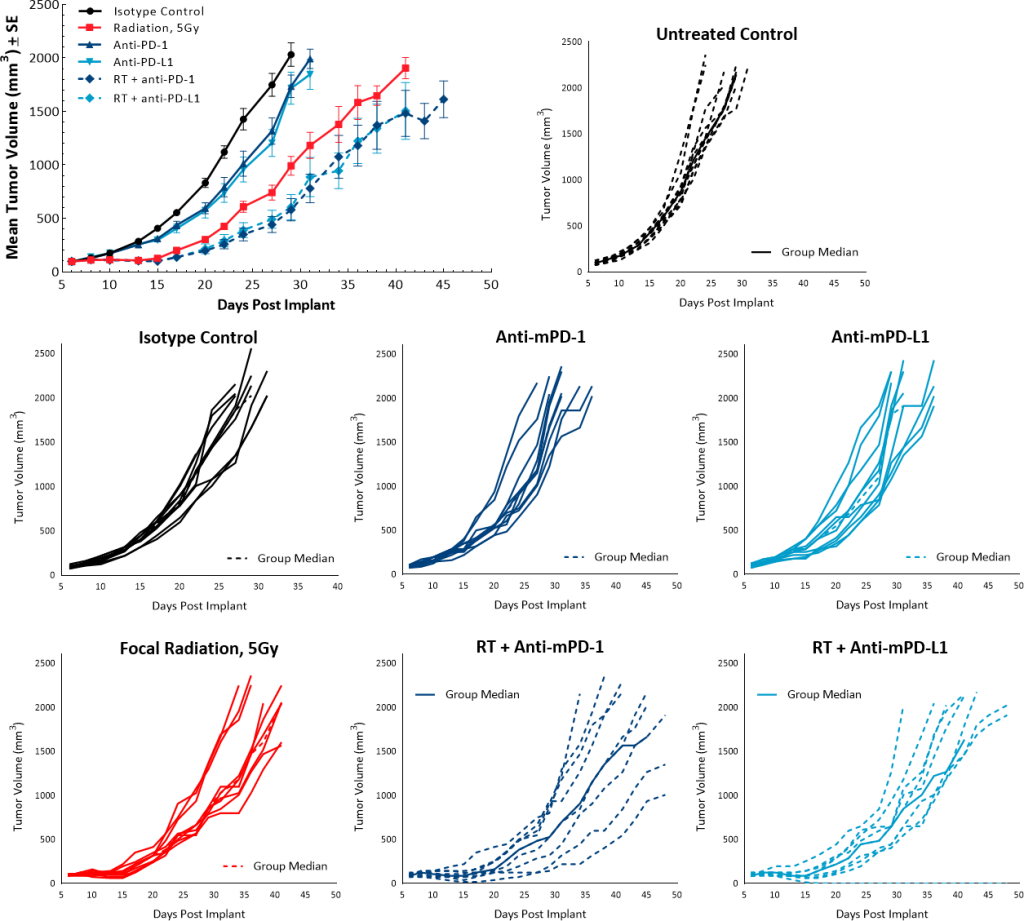
Fig. 6 : réponse de Pan02 à la combinaison d'irradiation et d'un inhibiteur de points de contrôle.
Travaux futurs avec le modèle Pan02
Des études sont en cours pour évaluer le potentiel de l'utilisation de combinaisons multiples pour améliorer la réponse au traitement dans le modèle Pan02 sous-cutané. En outre, nous avons récemment créé une lignée cellulaire Pan02 exprimant la luciférase pour permettre les études orthotopiques.
Références
2SEER Cancer Stat Facts. National Cancer Institute, NIH. (https://www.cancer.gov).
3Pancreatic Cancer Action Network (https://www.pancan.org/).
4Gunderson A.J., Yamazaki T., McCarty K. et al. Blockade of fibroblast activation protein in combination with radiation treatment in murine models of pancreatic adenocarcinoma. Plos One 2019, 14(2): e0211117.
5Kabacaoglu D., Ciecielski K.J., Ruess D.A. et Algul H. Immune checkpoint inhibition for pancreatic ductal adenocarcinoma: current limitations and future options. Frontiers in Immunology 2018, 9:1876.
6Saung M.T. et Zheng L. Current standards of chemotherapy for Pancreatic cancer. Clin. Ther. 2017,39(11):2125-2134.
7Azad A., Lim S.Y., D'Costa Z. et al. PD-L1 blockade enhances response of pancreatic ductal adenocarcinoma to radiotherapy. EMBO, Molecular Medicine 2017, 9(2):167-180.
8Lauffer D.C., Kuhn P.A., Kueng M. et al. Pancreatic cancer: Feasibility and outcome after radio-chemotherapy with high dose radiotherapy for non-resected and R1 resected patients. 2018. Cureus 10(5): e2713.
9Javle M., Golan T. et Maitra A. Changing the course of pancreatic cancer - focus on recent translational advances. Cancer Treatment Reviews. 2016; 44:17-25.
10Gajiwala S., Torgeson A., Garrido-Laguna I., Kinsey C. et Lloyd S. Combination immunotherapy and radiation therapy strategies for pancreatic cancer - Targeting multiple steps in the cancer immunity cycle. J Gastro Oncol, 2018; 9(6):1014-1026.
Connexion
Entamons le dialogue
Nous contacter