Date: October 2020
With the development of increasingly complex immunotherapies, biotech/pharma companies are now looking for more relevant and accurate preclinical tumor models to predict precise drug responses.
Si les études oncologiques précliniques visent à reproduire les maladies humaines chez l'animal, le plus grand défi que doivent relever les chercheurs est l'application des résultats chez l'humain. Un modèle préclinique idéal de tumeur n'utiliserait pas seulement le sous-type spécifique de cancer mais simulerait également le microenvironnement complexe nécessaire à la tumorigenèse.
Plusieurs publications récentes ont montré que le site d'implantation d'une tumeur peut avoir un impact sur des paramètres critiques tels que la cinétique de la tumeur, sa vascularisation, son architecture, l'environnement hypoxique et la sensibilité aux traitements anti-tumoraux1-4.
Les modèles sous-cutanés (SC) les plus fréquemment utilisés présentent l'avantage de contrôler les dimensions de la tumeur à l'aide d'un calibre. Cependant, ils diffèrent des tumeurs viscérales par leur morphologie, la densité des vaisseaux, les infiltrations de cellules immunitaires et le microenvironnement de la tumeur. Ce sont précisément les éléments qu'un modèle de tumeur orthotopique (OT) tente de saisir, c'est-à-dire l'implantation de lignées cellulaires tumorales ou de xénogreffes dérivées du patient dans l'organe qui correspond au type de tissu.
Dans le contexte spécifique de l'immunothérapie, les données publiées ont montré que les modèles de tumeurs OT sont immunosuppressifs avec une plus grande abondance de macrophages et peuvent être moins sensibles à certains types d'immunothérapie que le même modèle implanté de façon sous-cutanée2.
Pour explorer le potentiel des modèles OT à fournir un microenvironnement tumoral plus pertinent tout en agissant comme l'emplacement primaire de la tumeur par rapport aux modèles SC, nous avons activé la luciférase sur plusieurs lignées de cellules syngéniques pour faciliter le suivi non invasif de la progression et des métastases de la tumeur.
Dans cette présentation de modèle, nous examinons le développement du modèle Pan02-Luc, la lignée cellulaire de l'adénocarcinome pancréatique murin. Remarque : Tous les travaux sur les animaux ont été approuvés par le Comité institutionnel de soins et d'utilisation des animaux du centre et ont été effectués conformément au Guide pour le soin et l'utilisation des animaux de laboratoire dans le cadre d'un programme accrédité par l'AAALAC. Les critères humains d'euthanasie ont été prédéterminés sur la base du poids corporel et des observations cliniques définies.
Développement du modèle Pan02-Luc : lignée cellulaire de l'adénocarcinome pancréatique murin
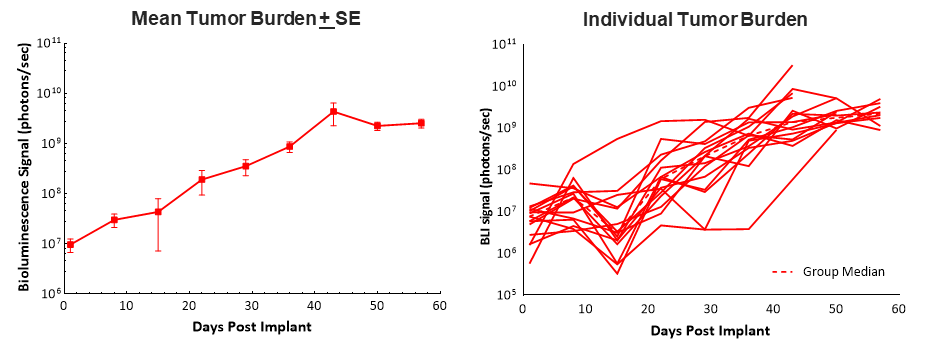
Suite à l'implantation chirurgicale de cellules Pan02-Luc dans la tête du pancréas de souris C57BL/6, ce sont environ 100 % des tumeurs qui se développent, suivant une croissance régulière, avec un temps de doublement médian d'environ 6 jours, d'après l'imagerie par bioluminescence (BLI). Les animaux ont eu une durée médiane de survie (morbidité/mortalité) relativement longue, de 58 jours, ce qui offre 5 à 6 semaines pour les dosages et l'évaluation de l'efficacité dans ce modèle (fig. 1). La greffe et la progression de la tumeur n'ont pas eu d'effet négatif sur le poids corporel et l'observation clinique la plus courante qui a conduit à l'euthanasie a été la distension abdominale (données non présentées).
On considère généralement les cancers du pancréas comme des tumeurs « froides », qui ne répondent pas bien à l'immunothérapie. Nous avons donc testé l'inhibiteur de point de contrôle anti-MPD-1 seul et en combinaison avec la gemcitabine.
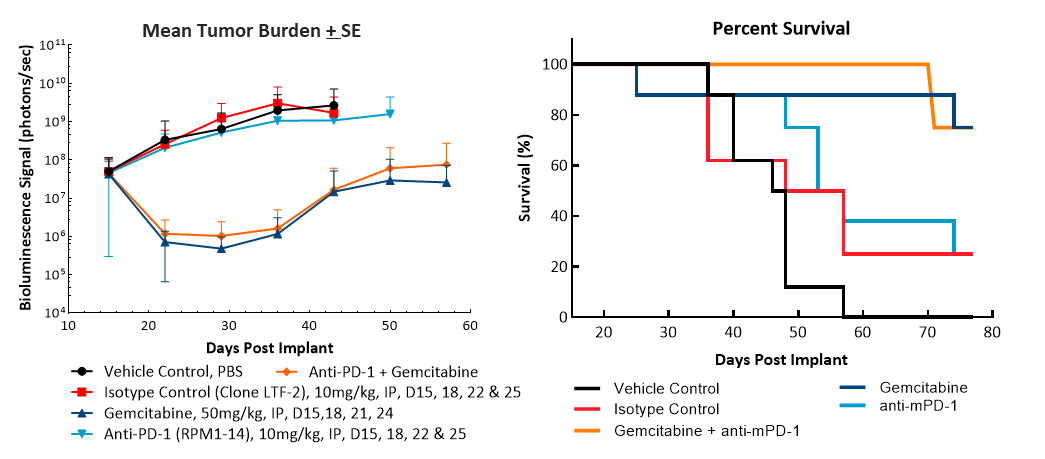
L'évaluation de l'efficacité suite au traitement à base d'anti-mPD-1 (10 mg/kg) n'a montré aucune réponse significative (fig. 2). Le traitement à la gemcitabine (50 mg/kg), agent de chimiothérapie standard cliniquement pertinent, a entraîné une régression tumorale complète (RC) chez 87 % (7/8) des animaux et 62 % (5/8) ont été considérés comme des survivants sans tumeur (SST) d'après la BLI. Une récidive a été observée chez deux animaux après la fin du traitement. La combinaison de la gemcitabine avec l'anti-MPD-1 n'a pas entraîné de SST supplémentaire par rapport à la gemcitabine en agent unique. Des images de bioluminescence (fig. 2C) et des images histologiques (fig. 2D) représentatives des tumeurs prises à la fin de l'étude confirment la régression tumorale dans les groupes traités à la gemcitabine.
Fig. 2. Réponse de Pan02-Luc aux traitements par anti-mPD-1 et gemcitabine

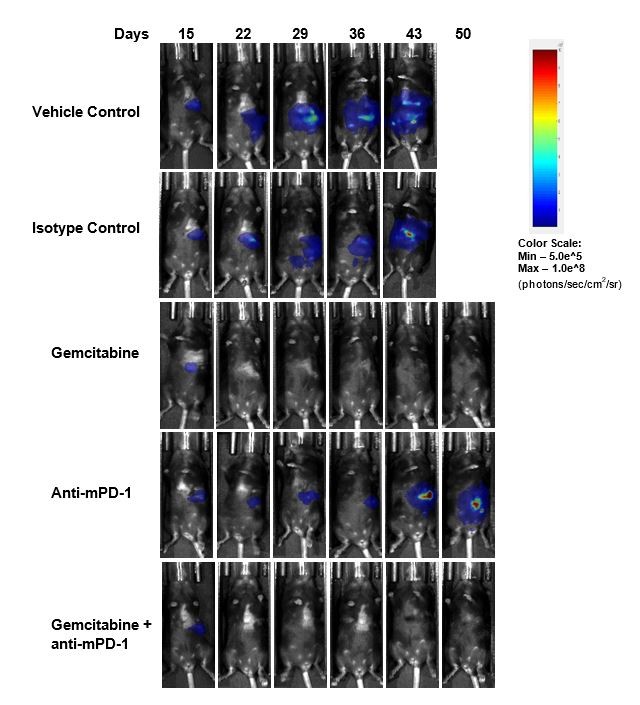
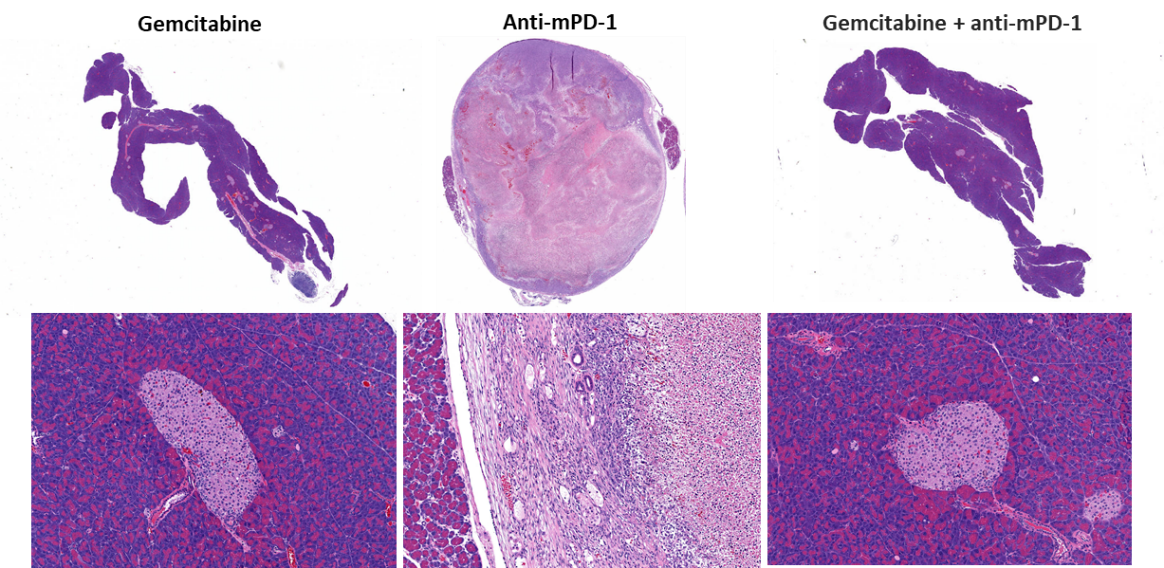
Nous avons précédemment fait état de la réponse du modèle Pan02 sous-cutané à l'immunothérapie (voir cette présentation de modèle antérieure). Ainsi, par rapport aux données OT présentées ici avec la lignée cellulaire Pan02 avec luciférase, nous avons constaté que la réponse à l'anti-mPD-1 dans le modèle OT était similaire à celle du modèle Pan02 SC. La réponse à la gemcitabine, administrée à la même concentration de dose, était significativement plus élevée dans le modèle OT que dans le modèle SC où les animaux présentaient un retard de croissance tumorale et 80 % de RP (régression partielle), 20 % de RC, et aucun SST (Tableau 1).
Table 1. Comparaison de la réponse des tumeurs SC et OT Pan02 au traitement à la gemcitabine
L'infiltration des cellules immunitaires dans les tumeurs OT a été évaluée par cytométrie en flux, ce qui a confirmé la faible infiltration des cellules lymphoïdes caractéristique d'un modèle de tumeur non immunogène ou « froid » (fig. 3A-B). Alors que les cellules T auxiliaires CD8+ et CD4+ ne constituaient que 1. 6 % et 1 % de la population CD45+, respectivement, les populations de cellules myéloïdes immunosuppressives étaient présentes en abondance, les cellules myéloïdes suppressives monocytiques (M-MDSC) et les macrophages associés aux tumeurs (TAM) M1 et M2 étant les sous-populations cellulaires dominantes. La comparaison des profils immunitaires des modèles OT et SC a montré que les lymphocytes T régulateurs (Tregs), les cellules natural killer (NK) et les lymphocytes T natural killer (NKT) étaient significativement peu nombreux dans les tumeurs OT. La population myéloïde, en général, était plus importante dans les tumeurs OT constituant jusqu'à 82 % des cellules CD45+, alors qu'elle était de 68 % dans le modèle SC. Les MDSC granulocytaires et les M2-TAM étaient significativement plus élevées dans les tumeurs OT tandis que les cellules dendritiques étaient plus basses et représentaient un phénotype immunosuppresseur plus anti-inflammatoire.
Fig. 3. Analyse par cytométrie en flux des tumeurs SC et OT
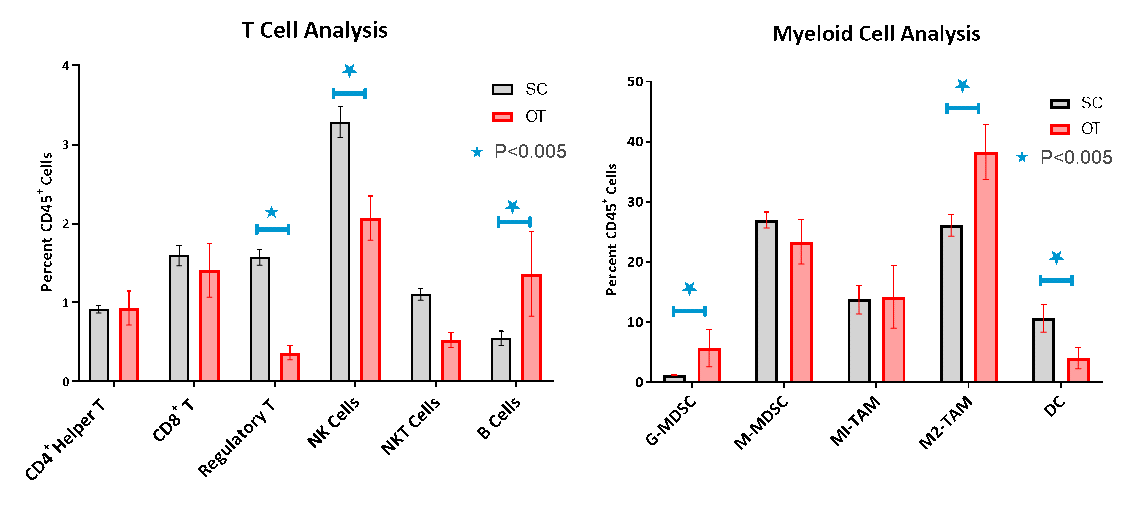
Ces différences subtiles entre le modèle SC et le modèle OT peuvent donner un aperçu de l'intensité de la réponse aux traitements que nous avons étudiés. Ces différences s'avèrent critiques sur le plan clinique car elles influencent la prévisibilité de la réponse et du pronostic chez les patients atteints d'un cancer du pancréas5-7.
L'implantation orthotopique des tumeurs permet de modéliser la progression du cancer et la réponse aux médicaments d'une manière qui simule mieux les scénarios cliniques. Comme chaque organe et son microenvironnement sont uniques et ne peuvent pas être reproduits par implantation sous-cutanée, il est important d'utiliser le modèle orthotopique lorsqu'il est disponible.
At preclinical oncology, we offer several luciferase-enabled models for this purpose.
Veuillez nous contacter si vous souhaitez en avoir plus sur ce modèle plus en détail.
Références
1. Erstad DJ, et al., 2018. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy. Dis Model Mech., Jul 1; 11(7): dmm034793
2. Devaud C, et al., 2014. Tissues in different anatomical sites can sculpt and vary the tumor microenvironment to affect responses to therapy. Mol Ther., janv. 22(1):18-27
3. Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N and Trautmann A, 2020. Preclinical murine tumor models: a structural and functional perspective. eLife., 2020;9:e50740
4. Qui W and Su GH. 2013. Development of orthotopic pancreatic tumor mouse models. Methods Mol Biol., 980:215-223
5. Kurahara H, et al., 2011. Significance of M2-polarized tumor-associated macrophage in pancreatic cancer. J Surg Res., mai 15; 167(2):e211-e219
6. Parente P, et al., 2018. Crosstalk between the tumor microenvironment and immune system in pancreatic ductal adenocarcinoma: Potential targets for new therapeutic approaches. Gastroenterology Res and Practice. 2018:7530619
7. Lankadasari M, et al., 2019. TAMing pancreatic cancer: combat with a double-edged sword. Mol Cancer 18:48
Connexion
Entamons le dialogue
Nous contacter