Date: January 2018
Dans cet article, nous présenterons la détection des phospho-protéines dans les tumeurs solides par cytométrie en flux phospho et nous passerons en revue l'analyse de l'inhibition de la signalisation PI3K/AKT et JAK-STAT induite par le cabozantinib dans les cellules immunitaires de la tumeur et de l'hôte.
The in vivo efficacy of small molecule inhibitors is often assessed by measuring the phosphorylation state of cell signaling proteins within the pathways the drug targets. Ceci peut constituer un véritable défi lorsque l'analyse des tumeurs solides est nécessaire. Dans la recherche préclinique qui utilise des modèles de rongeurs, les approches les plus fréquentes pour l'analyse des tumeurs sont le western blot et les techniques de type ELISA. Cependant, ces méthodes d'analyse globale présentent deux inconvénients majeurs. Leur capacité relative à mesurer simultanément plusieurs cibles est loin d'être optimale. En outre, elles ne permettent pas d'analyser des cibles dans plusieurs sous-ensembles distincts au sein de l'échantillon hétérogène de la tumeur. Cela peut être important lorsque la protéine de signalisation cible a des fonctions opposées dans différents types de cellules du microenvironnement de la tumeur, telles que les cellules immunitaires par rapport aux cellules tumorales, et même critique si les effets induits par le médicament se produisent dans un sous-ensemble mais pas dans les deux.
Labcorp has developed a novel phospho-flow-based platform that simultaneously analyzes multiple cell signaling targets in both the host immune cell and the tumor cell compartments derived from solid tumors. Pour ce faire, on distingue les cellules tumorales des cellules immunitaires infiltrantes de l'hôte par immunophénotypage pour le marqueur des cellules pan-hématopoïétiques CD45, avant l'analyse des phospho-protéines. Pour démontrer l'utilité de cette plateforme, les niveaux de STAT5 phosphorylé et la cible en aval des AKT (S6) ont été mesurés dans des tumeurs MV-4-11 sous-cutanées récoltées chez des souris traitées avec du cabozantinib, un inhibiteur de FLT3 . La figure 1 montre que le cabozantinib réduit les niveaux de pS6 et de pSTAT5 dans les cellules tumorales humaines (h)CD45+. Aucune modification des niveaux de ces phospho-protéines n'a été observée dans les cellules immunitaires de l'hôte (m)CD45+ de la souris (données non présentées). On obtient ainsi un aperçu de l'activité de signalisation des PI3K/AKT et JAK-STAT, qui sont des voies bien documentées qui régulent à la fois la croissance de la tumeur et l'immunité de l'hôte, et qui constituent des cibles intéressantes pour une intervention thérapeutique.
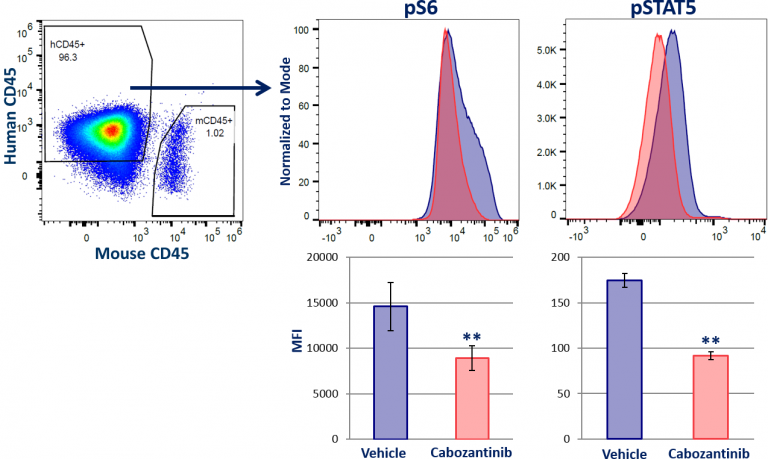
Fig. 1 : analyse par phospho-flow de la signalisation de STAT5 et de MAPK dans une tumeur solide.
MV-4-11 est un modèle de leucémie myéloïde aiguë (LMA), une affection maligne provoquée par une mutation génétique dans un ou plusieurs gènes. L'événement le plus courant se produit dans le gène FLT3, qui donne naissance à une protéine FLT3 constitutivement active qui entraîne la prolifération des cellules cancéreuses en déclenchant l'hyper-activation de la signalisation de PI3K/AKT et JAK-STAT1. Il a été démontré que l'inhibition de la FLT3 par le cabozantinib arrête la croissance des tumeurs MV-4-11 in vivo, ce qui est corrélé avec une inhibition de la signalisation d'AKT et de STAT in vitro2. Bien que la signalisation de PI3K/AKT et de JAK-STAT5 hyperactive ait été bien documentée pour stimuler la croissance tumorale dans de nombreux modèles, l'activité de ces protéines de signalisation est également nécessaire à l'activation des cellules T et à la formation de cellules T mémoires3,4,5. Cette dichotomie souligne l'importance de pouvoir analyser simultanément les phospho-protéines dans les cellules immunitaires et tumorales dérivées de tumeurs solides.
Tumor phospho-flow at Labcorp has potential to advance the cell signaling field. Le phospho-flux des tissus solides a été décrit en 2010 dans l'étude des tumeurs pulmonaires et péritonéales6. Depuis, les rapports sur d'autres approches réussies sont rares. Plus récemment, une approche appelée DISSECT a été associée à la cytométrie et utilisée avec succès pour mesurer les phospho-protéines dans les échantillons d'épithélium, et plus tard les tumeurs colorectales7,8. Il convient de noter que ces approches nécessitent une fixation après le prélèvement des tissus, ce qui peut modifier les épitopes qui sont liés par les anticorps fluorescents utilisés à la fois pour l'immunophénotypage et l'analyse de la signalisation. Ceci peut limiter la quantité de données fournies par ces techniques. Solid tumor phospho-flow at Labcorp does not require fixation, prior to immuno-staining. Ceci nous permet de cibler plus facilement différentes populations au moment de l'analyse. Nous cherchons actuellement à développer nos capacités. Nos efforts actuels concernent le développement de nouveaux services en phospho-flow pour l'étude des tumeurs solides, qui permettront l'analyse in vivo simultanée des effets du traitement sur des sous-ensembles spécifiques de cellules T et sur les cellules tumorales.
Contact us to learn more about solid tumor phospho-flow, as well as information on our expanding list of signaling proteins for which we can provide analysis.
Références
2Lu, J. W. ; Wang, A. N. ; Liao, H. A.; Chen, C. Y. ; Hou, H. A. ; Hu, C. Y. ; … et Lin, L. I. (2016). Cabozantinib is selectively cytotoxic in acute myeloid leukemia cells with FLT3-internal tandem duplication (FLT3-ITD). Cancer letters, 376(2), 218-225.
3Vara, J. Á. F. ; Casado, E. ; de Castro, J. ; Cejas, P.; Belda-Iniesta, C. ; & González-Barón, M. (2004). PI3K/Akt signalling pathway and cancer. Cancer treatment reviews, 30(2), 193-204.
4Rani, A. et Murphy, J. J. (2016). STAT5 in cancer and imCantrell, D. (2002, février).
5Protein kinase B (Akt) regulation and function in T lymphocytes. In Seminars in immunology (Vol. 14, No. 1, pp. 19-26). Academic Press.
6Lin, C. C. ; Huang, W. L. ; Su, W. P. ; Chen, H. H. ; Lai, W. W. ; Yan, J. J. et Su, W. C. (2010). Single cell phospho‐specific flow cytometry can detect dynamic changes of phospho‐Stat1 level in lung cancer cells. Cytometry Part A, 77(11), 1008-1019.
7Simmons, A. J. ; Banerjee, A. ; McKinley, E. T. ; Scurrah, C. R. ; Herring, C. A. ; Gewin, L. S. ; … et Irish, J. M. (2015). Cytometry‐based single‐cell analysis of intact epithelial signaling reveals MAPK activation divergent from TNF‐α‐induced apoptosis in vivo. Molecular systems biology, 11(10), 835.
Connexion
Entamons le dialogue
Nous contacter