Date: September 2018
Le cancer de l'ovaire est considéré comme une malignité gynécologique relativement rare, mais il présente l'un des taux de mortalité les plus élevés en raison des symptômes non spécifiques qui apparaissent au stade précoce de la maladie. Cela signifie qu'un grand nombre de femmes ne sont diagnostiquées qu'à un stade avancé de la maladie. L'incidence du cancer ovarien aux États-Unis est d'environ 22 000 cas par an et il est à l'origine d'environ 14 000 décès par an.
Même si un certain nombre de progrès ont été réalisés dans les traitements du cancer et les approches chirurgicales, peu de progrès dans le traitement du cancer de l'ovaire ont eu un impact significatif sur cette population de patients. Si le taux de réponse initial peut être élevé, plus de 80 % des patientes rechuteront après un traitement de première ligne et plus de 50 % de ces femmes mourront dans les 5 années suivant le diagnostic.
Des possibilités limitées en seconde intention chez les patients réfractaires à la première ligne de traitement ainsi que les diagnostics tardifs contribuent à la faible survie globale et en font un besoin médical hautement insatisfait constituant un domaine actif de la découverte de médicaments en oncologie. Les succès récents en matière d'immunothérapie pour les autres cancers constituent une source d'espoir pour les patientes souffrant du cancer ovarien. L'une des données les plus prometteuses indique que la présence de lymphocytes infiltrant la tumeur est positivement corrélée à l'amélioration de la survie globale des patientes atteintes d'un cancer de l'ovaire[1].
Modèle de carcinome ovarien murin ID8 proposé comme modèle syngénique préclinique
At Labcorp we have established the ID8 murine ovarian carcinoma model as a preclinical syngeneic model that can be used to track and monitor disease progression and therapeutic outcomes. Notre modèle est fondé sur l'apport intrapéritonéal de cellules ID8 exprimant la luciférase afin d'imiter les aspects de la maladie humaine. Après l'implantation in vivo, les cellules ID8-luc ont un temps de doublement de la tumeur de 7 à 8 jours et une survie globale médiane d'environ 40 à 50 jours. Aucune perte de poids corporel n'a été observée dans ce modèle. Au contraire, la prise de poids est fréquente en raison de l'accumulation d'ascites péritonéales associées au stade avancé de la maladie (figures 1A, B, C).
Fig. 1 : évaluation in vivo du modèle ID8-luc Model chez la souris C67BL/6 au cours du temps
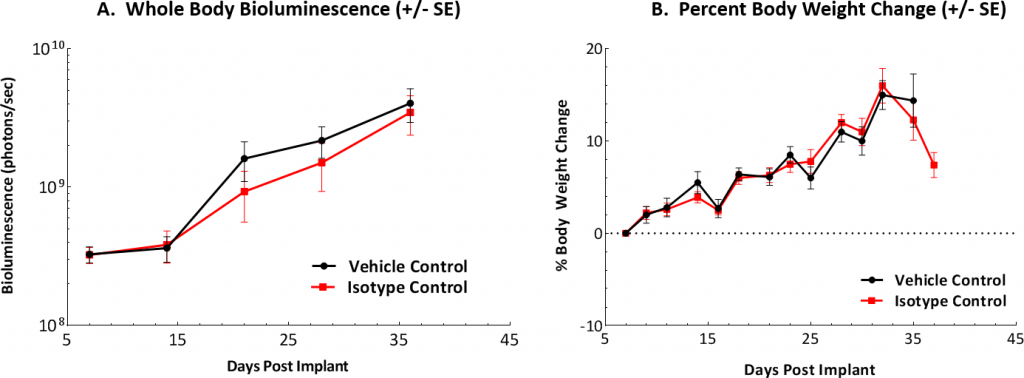
Fig. 1A : représentation graphique de la charge tumorale trouvée chez les souris témoins après implantation intrapéritonéale.
Fig. 1B : le poids corporel a été mesuré trois fois par semaine et c'est le changement en pourcentage par rapport au jour d'implantation (jour 0) qui est montré.
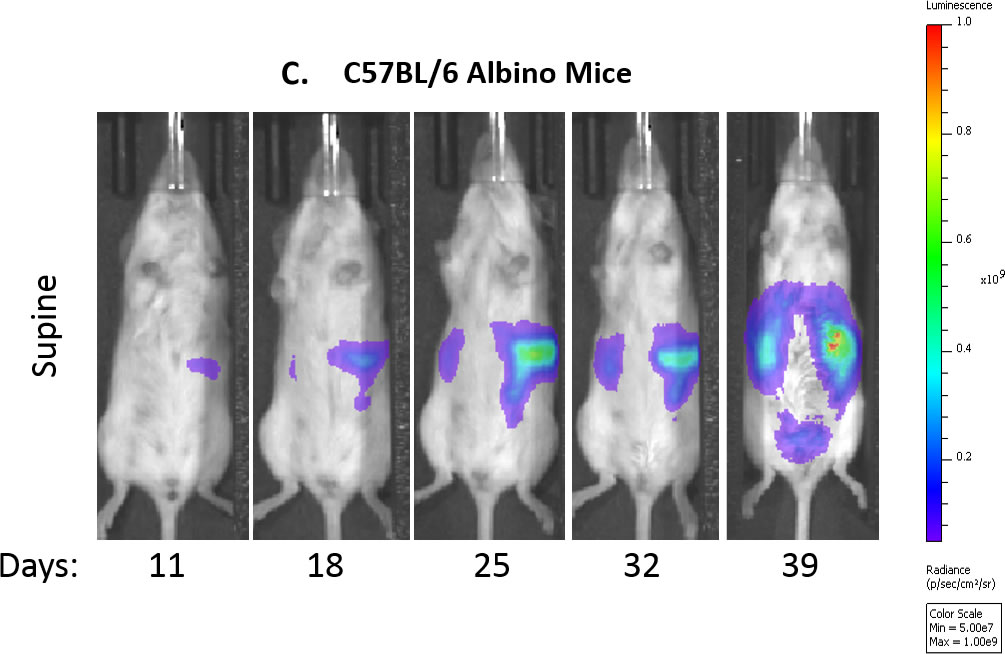
Fig. 1C : images par bioluminescence représentatives de la souris témoin au cours du temps.
Évaluation de l'immunophénotype du liquide de l'ascite
Les observations cliniques incluent l'extension de l'abdomen due à l'accumulation d'ascite à un stade plus avancé de la maladie. Lors de la nécropsie, on observe des nodules tumoraux solides dans la cavité péritonéale, y compris le pancréas, le foie, la rate et la paroi abdominale.
La compréhension du profil des cellules immunitaires des modèles syngéniques joue un rôle important dans le choix du modèle. Nous avons donc évalué l'immunophénotype du liquide d'ascite (figures 2A, B, C) et avons trouvé un grand pourcentage de cellules B, de cellules myéloïdes suppressives granulocytaires (G-MDSC), et de cellules macrophages associées aux tumeurs (TAM) M1 et M2. Une évaluation plus poussée des nodules de tumeurs solides observés est en cours.
Fig 2 : immunophénotypage des ascites chez la souris avec tumeur ID8-luc implantée
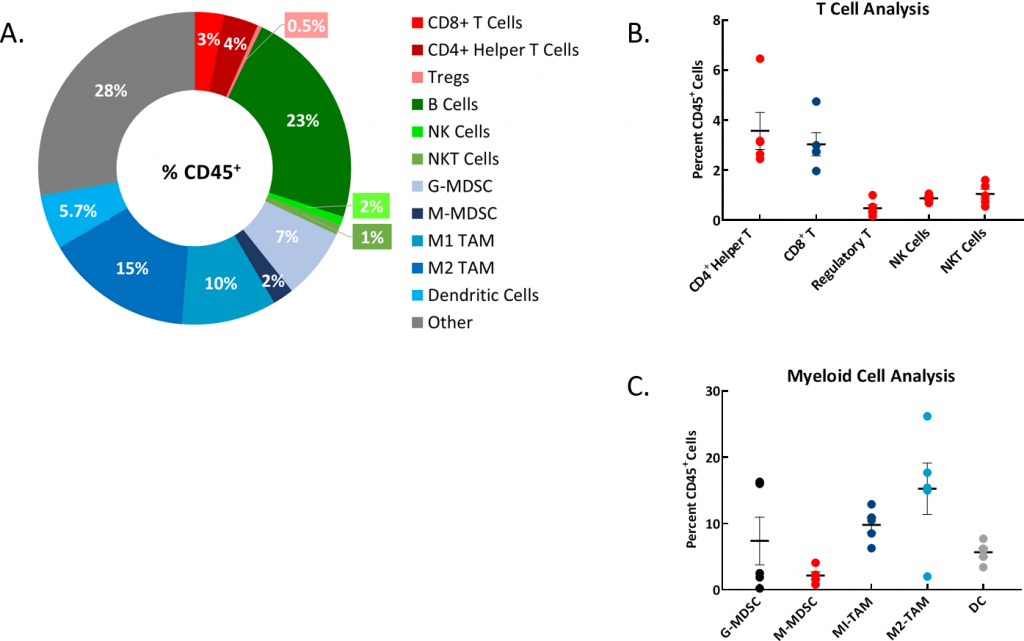
Fig. 2A : le graphique en anneau représentatif montre la distribution des populations de cellules immunitaires en pourcentage de la population totale de CD45+.
Fig 2B : analyse des populations de lymphocytes T.
Fig. 2C : analyse des populations de cellules myéloïdes. Étude réalisée avec des échantillons d'ascites de n=5 souris.
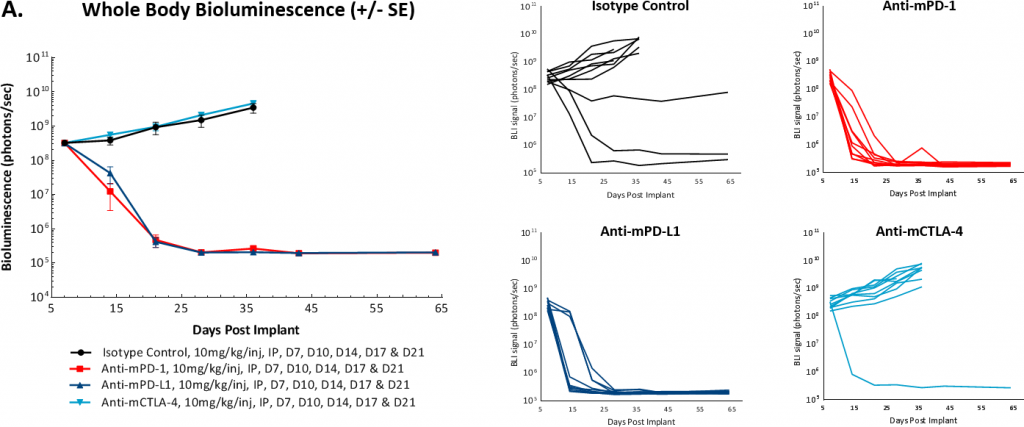
Pour déterminer si le modèle répondait à l'inhibition du point de contrôle immunitaire, nous avons testé des anticorps anti-mPD-1, anti-mPD-L1 et anti-mCTLA-4 à partir de 7 ou 14 jours après l'implantation des cellules tumorales. Comme de nombreux modèles de tumeurs syngéniques solides, nous avons constaté que la réponse à ces thérapies varie en fonction du moment où le traitement a été instauré. Dans les figures 3A et 3B, nous montrons que l'initiation d'un traitement avec des anticorps anti-mPD-1 ou anti-mPD-L1 7 jours après l'implantation des cellules tumorales a entraîné une régression complète des tumeurs, ce qui rend ce délai inadapté à la combinaison avec des médicaments. Au contraire, le modèle semble réfractaire au traitement par anti-mCTLA-4. De plus, nous avons observé qu'un faible pourcentage de tumeurs témoins régressaient spontanément au début de l'étude, au jour 7.
Fig 3 : ID8-luc intrapéritonéale : signal BLI moyen et individuel dans le corps entier au fil du temps
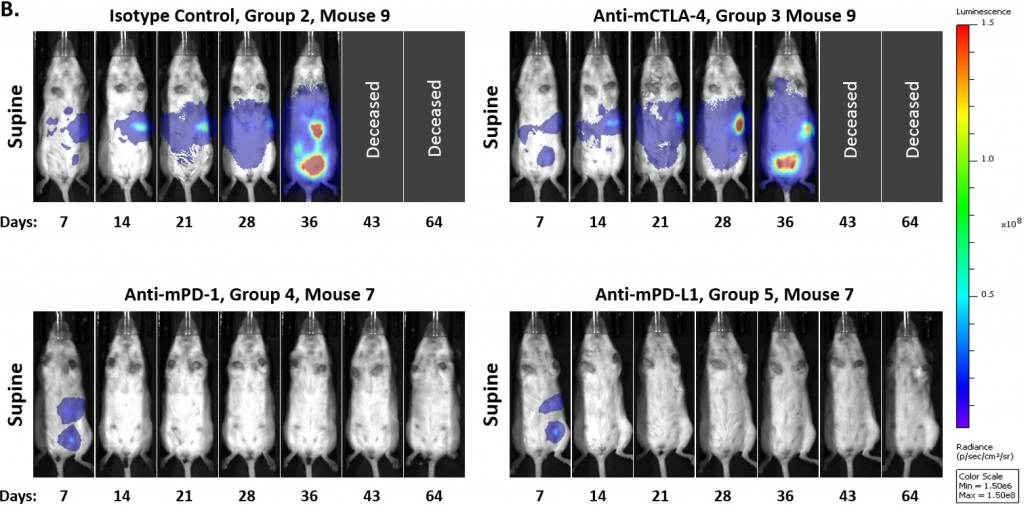
Dans une étude ultérieure, nous avons retardé le début du traitement à 14 jours après l'implantation des cellules tumorales et n'avons pas observé de régression spontanée des tumeurs témoins. Nous avons également noté une modulation du taux de réponse global aux thérapies anti-mPD-1 ou anti-mPD-L1. Cependant, il semble à nouveau que ces anticorps produisent une réponse au traitement de type « tout ou rien ». En outre, la réduction de la dose d'anticorps de 10 mg/kg à 5 mg/kg n'a pas eu d'impact significatif sur l'activité anti-tumorale de ces agents (figure 4). Les recherches futures évalueront un dosage des anticorps encore davantage retardé afin de déterminer si nous pouvons continuer à réduire l'activité monoagent de ces inhibiteurs de points de contrôle.
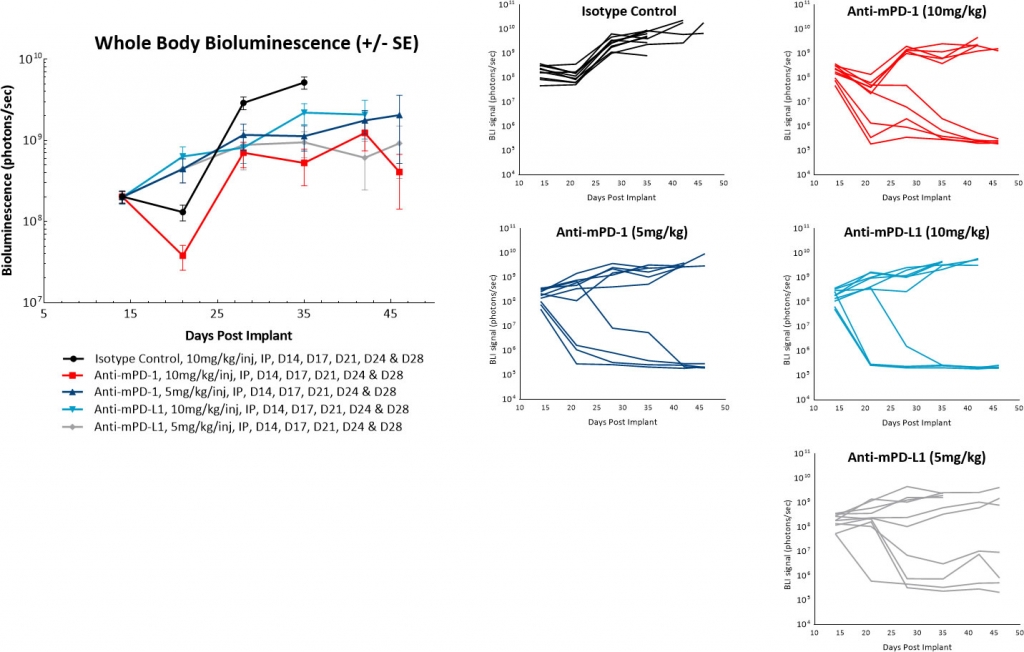
Tableau 1 : lignées cellulaires du cancer du poumon
Voir notre courbe de croissance de l'A549 :
A549 : carcinome pulmonaire humain
Labcorp has multiple lung cancer cell lines available for use (Table 1). Please contact us to run your next lung cancer study.
Fig 4 : ID8-luc intrapéritonéale : signal BLI moyen et individuel dans le corps entier après traitement avec des anticorps inhibiteurs de point de contrôle
Références
Connexion
Entamons le dialogue
Nous contacter