Date: October 2019
Le cancer du poumon est le deuxième cancer le plus couramment diagnostiqué chez les hommes et les femmes aux États-Unis et c'est, de loin, la cause la plus fréquente de décès des suites d'un cancer chez les hommes et les femmes. En 2019, l'American Cancer Society estime que 228 150 nouveaux cas de cancer du poumon (116 440 chez les hommes et 111 710 chez les femmes) seront diagnostiqués et 142 670 décès par cancer du poumon (76 650 chez les hommes et 66 020 chez les femmes) auront lieu.
The number of deaths caused by lung cancer peaked in 2005 at 159 292 and has been gradually declining ever since.[1] However, the five-year lung cancer survival rate is only around 20 % and is considerably lower than other cancers. Si le cancer du poumon est détecté à un stade précoce, la survie à cinq ans augmente d'environ 56 %, mais seulement environ 16 % des cancers du poumon sont détectés à un stade aussi précoce. Pour une détection à un stade plus avancé, le taux de survie à cinq ans peut ne pas dépasser 5 %.
Il existe de nombreux traitements possibles pour le cancer du poumon, en fonction du type de cancer du poumon diagnostiqué et du stade de la maladie. Tous les types de traitements, de la chirurgie à la chimiothérapie, en passant par la radiothérapie, la thérapie ciblée et l'immunothérapie, sont utilisés cliniquement. Malgré certains succès, notamment chez les patients présentant certaines mutations génétiques et, plus récemment, grâce à de nouvelles immunothérapies, le pronostic général reste médiocre. Il est donc nécessaire de développer en permanence de nouveaux traitements pour le cancer du poumon.
La découverte de l'immunothérapie a nécessité des modèles de tumeurs de souris syngéniques pour faire progresser le développement des traitements immuno-oncologiques. One of these models is the LL/2 (Lewis Lung) lung carcinoma model that has been characterized by Labcorp to support development of novel agents. La lignée de cellules LL/2 a été développée à partir d'un nodule de tumeur primaire du modèle de carcinome du poumon de Lewis qui s'est spontanément développé comme un carcinome épidermoïde dans le poumon d'une souris C57BL. Comme indiqué ci-dessous, le LL/2 est classé comme une tumeur « froide » avec une faible infiltration de cellules T et une forte infiltration de cellules myéloïdes suppressives. Comme de nombreux patients atteints de cancer ne répondent pas aux immunothérapies actuelles, comprendre les modèles de tumeurs « froides » est une partie importante du développement et de l'utilisation des approches de la souris syngénique pour la découverte et le développement de médicaments.
Profil immunitaire des tumeurs LL/2
Baseline immune profile of LL/2 tumor infiltrates was determined on 6 untreated tumors (~500mm3) analyzed with the Labcorp CompLeukocyteTM Package. Parmi les cellules CD45+ infiltrant ces tumeurs, les M-MDSC représentaient la plus grande population cellulaire (37 %) suivie des G-MDSC (22 %) et des TAM M2 (20 %). Les cellules T (à la fois CD8+ et CD4+), ainsi que les TAM M1, les cellules B, les NK, les NKT et les cellules dendritiques étaient peu représentées (Fig. 1). Le profil général suggère un modèle non immunogène.
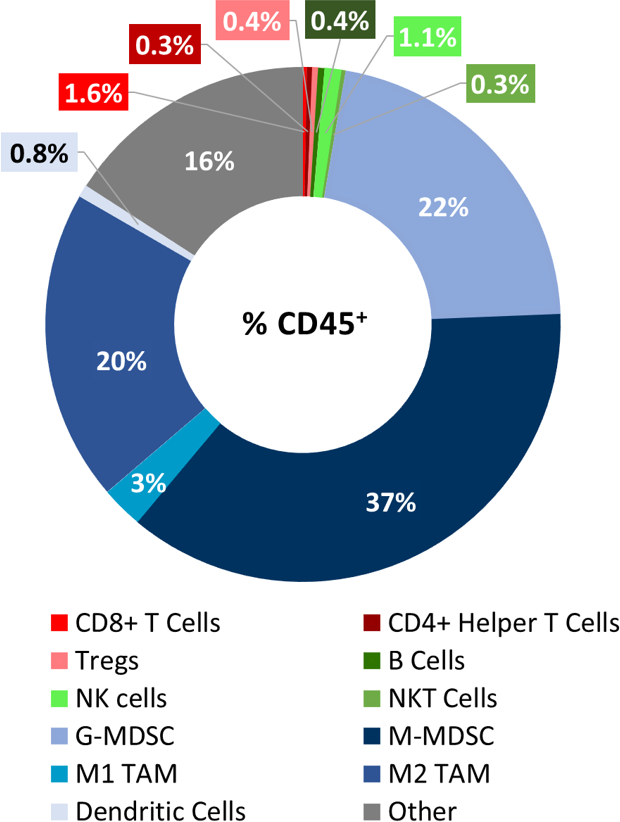
Fig. 1 : immunophénotypage d'infiltrats de cellules immunitaires dans la tumeur dans le modèle LL/2.
Croissance du LL/2 et réponse au traitement
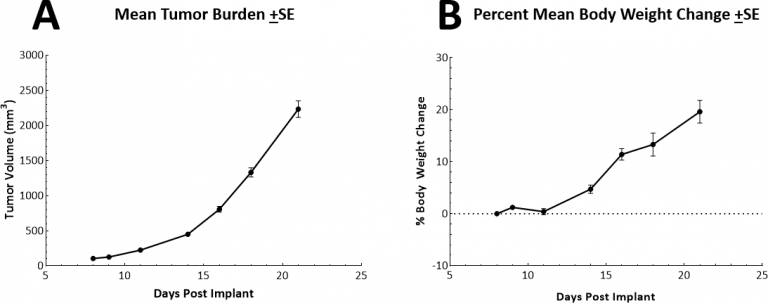
Le temps de doublement in vivo des tumeurs LL/2 sous-cutanées (SC) est très rapide, d'environ 2,5-3 jours. Il en résulte un modèle qui peut offrir une fenêtre de dosage allant jusqu'à deux semaines pour les agents de test afin de susciter leur activité antitumorale. Le modèle lui-même n'entraîne pas de réduction du poids corporel (Fig. 2A, 2B).
Il existe diverses approches de chimiothérapie pour le cancer du poumon et, en conséquence, nous avons testé la doxorubicine et le paclitaxel en tant qu'agents uniques dans le modèle LL/2. La doxorubicine est une anthracycline qui présente une activité antitumorale à large spectre, et le paclitaxel est un agent de liaison à la tubuline qui est largement utilisé pour le traitement du cancer du poumon non à petites cellules (CPNPC). Dans le modèle LL/2, aucun des agents testés n'a démontré de réponses antitumorales significatives à la dose et aux schémas que nous avons examinés (Fig. 3A et B).
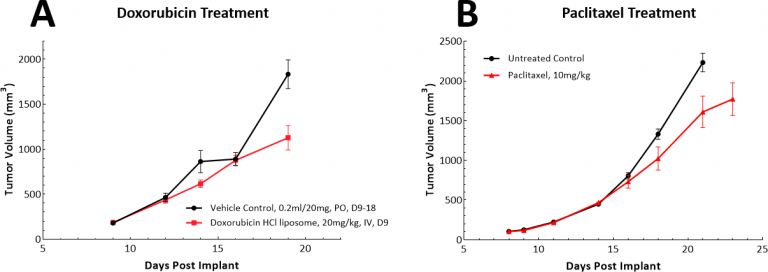
Fig. 3 : réponse des tumeurs sous-cutanées LL/2 à un seul agent, la doxorubicine ou le traitement au paclitaxel.
Avec le développement de l'immunothérapie, nous avons également examiné si le modèle LL/2 répondrait aux inhibiteurs de points de contrôle à agent unique, anti-PD-1 ou anti-PD-L1. (Fig. 4). La figure 4 montre les volumes moyens des tumeurs (Fig. 4A) et les volumes individuels des tumeurs (Fig. 4B, C, et D) après traitement par contrôle d'isotype, anti-PD-1 ou anti-PD-L1. La prise de dose avec tous les agents de test a commencé dès l'apparition des tumeurs (environ 100 mm3).). Comme on pouvait s'y attendre, aucun des deux agents testés n'a montré de bénéfice thérapeutique en raison du microenvironnement tumoral hautement immunosuppressif de ce modèle. Nous avons ensuite émis l'hypothèse que l'association du paclitaxel avec des inhibiteurs des points de contrôle immunitaires apporterait un bénéfice combiné (Fig. 5A et B). Toutefois, cette approche n'a pas permis d'améliorer les résultats pour les souris, ce qui confirme la position selon laquelle le modèle a un phénotype « froid ». Il est possible que les approches à triple combinaison puissent apporter des avantages dans ce modèle et que ceux qui recherchent des approches pour gérer les tumeurs « froides » trouvent ce modèle utile.
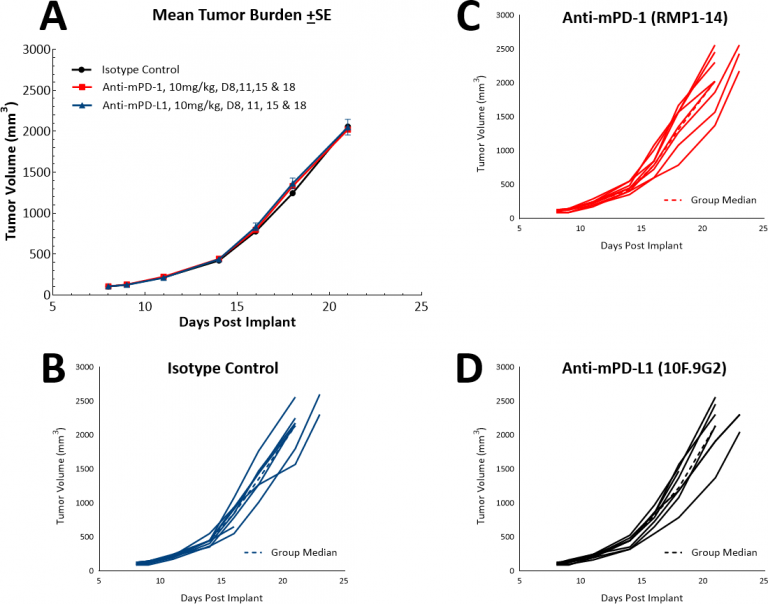
Fig. 4 : réponse des tumeurs sous-cutanées LL/2 aux inhibiteurs de points de contrôle à agent unique, anti-PD-1 ou anti-PD-L1.
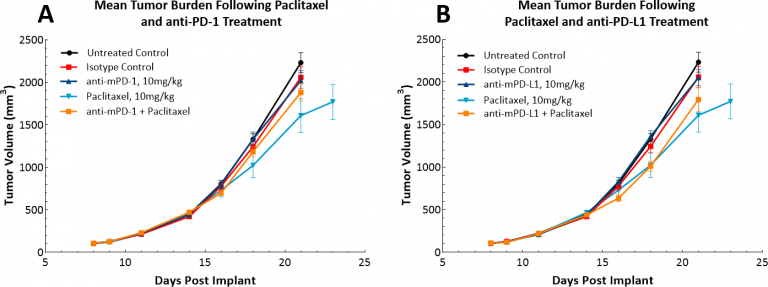
Fig. 5 : réponse des tumeurs sous-cutanées LL/2 au traitement combiné avec inhibiteurs du verrou et paclitaxel.
Tumeurs LL/2 suite à une radiothérapie localisée seule ou en assosciation avec un anti-PD-1
Chez les patients atteints d'un cancer du poumon, la radiothérapie est couramment utilisée à la fois seule, en tant que monothérapie palliative, et en association avec la chimiothérapie. While focal radiation is highly recommended, we have utilized our RadSource RS-2000 to deliver localized radiation in a few models. Dans le modèle LL/2 sous-cutané, nous avons testé une dose unique élevée (20 Gy) d'irradiation localisée sur des souris ayant des tumeurs sous-cutanées implantées dans la région lombo-sacrée. Nous avons constaté que les radiations seules augmentaient le délai d'évaluation de 36 jours par rapport à 20 jours dans le groupe de contrôle. Avec l'ajout de l'anti-PD-1, le délai d'évaluation a légèrement augmenté pour atteindre 38,5 jours, ce qui indique que le traitement combiné ne présente aucun avantage supplémentaire (Fig. 6). Toutefois, une triple association de radiations, de blocage des points de contrôle immunitaires et d'une nouvelle thérapie pourrait être testée ultérieurement dans ce modèle.
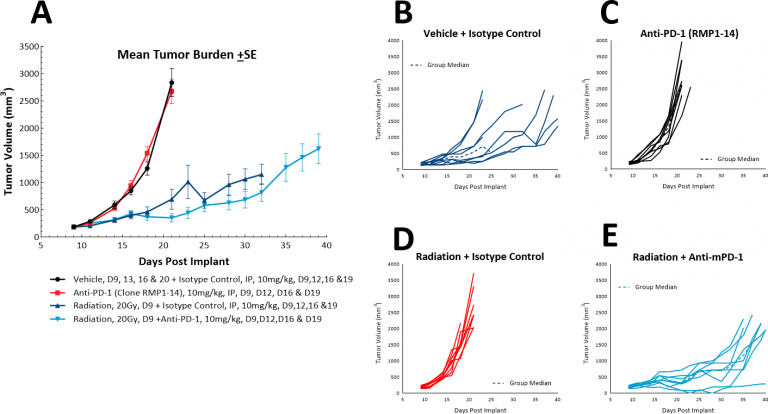
Fig. 6 : réponse des tumeurs sous-cutanées LL/2 au traitement combiné avec irradiation localisée et l'anti-PD-1.
Les modèles de tumeurs sous-cutanées sont utiles pour évaluer rapidement et relativement facilement l'activité antitumorale. Toutefois, en raison de la nature de l'emplacement de l'implant, ces tumeurs peuvent ne pas reproduire toute la biologie nécessaire qui représenterait plus fidèlement la maladie chez le patient. Nous disposons pour cela d'une version luciférique de LL/2, LL/2-Luc-M38, qui est utilisée pour développer le modèle LL/2 dans le cadre du poumon orthotopique.
Le modèle de carcinome pulmonaire murin LL/2 peut être utilisé comme modèle d'immuno-oncologie préclinique. Nos données soutiennent l'utilisation de cet outil dans l'étude de nouvelles combinaisons de traitement avec des radiations ou des inhibiteurs de points de contrôle, ou d'autres nouvelles approches du traitement des tumeurs non immunogènes « froides ».
Please contact us to speak with our scientists about how LL/2 or one of our other syngeneic models can be used for your next immuno-oncology study.
Références
Connexion
Entamons le dialogue
Nous contacter