Date: November 2019
Le carcinome hépatocellulaire (CHC) touche plus d'un million de personnes au niveau international. Il s'agit de nos jours de la plus importante cause de décès liés au cancer, et ce, dans le monde entier.[1] Sur le plan international, chaque année, 800 000 nouveaux diagnostics sont posés et 700 000 patients décèdent. The incidence of HCC is highest in Southeast Asia and Sub-Saharan Africa due to high prevalence of hepatitis B and C viruses which strongly predisposes one to develop chronic liver disease and subsequent HCC.[1,2] In the United States, there are expected to be 42 030 new diagnoses and 31 780 patient deaths in 2019.[2]
Depending on the stage of disease, HCC can be treated with surgery, chemotherapy, targeted therapies, and radiation.[4] Current clinical trials are tackling unresectable or advanced stage HCC with mono or combination immunotherapy, monoclonal antibodies or oncolytic virus therapy.[1-4] These approaches have demonstrated tumor shrinkage and improved survival, but are not curative. Il est donc nécessaire d'améliorer les options de traitement. Labcorp has developed the syngeneic HCC model, Hepa 1-6, for preclinical evaluation of immunomodulatory drug candidates.
Hepa 1-6 est un hépatome murin dérivé de l'hépatome BW7756 apparu spontanément chez les souris C57L/J. Ceci diffère de la plupart des modèles d'hépatome disponibles (BNL, A.7R.1, MH-129, MH134 et MH-22A), qui sont des lignées modifiées ou induites chimiquement. Par conséquent, le modèle de tumeur Hepa 1-6 établi chez les souris immunocompétentes représente un modèle cliniquement pertinent pour les tests précliniques dans un contexte d'immunothérapie.
Analyse des précédentes données
Dans notre présentation du modèle Hepa 2018-1, nous avons présenté la croissance sous-cutanée initiale du modèle et les données de réponse suite au début de l'administration de la dose en présence de petites tumeurs bien établies (volume moyen des tumeurs : ~80-90 mm3). Le traitement de Hepa 1-6 avec des inhibiteurs des points de contrôle in vivo a été extrêmement efficace pour les stades précoces de la maladie, obtenant 50 à 100 % de réponses complètes durables. Cependant, cela laissait peu de place aux améliorations en combinaison avec les médicaments candidats. En 2019, nous avons poursuivi nos efforts pour optimiser ce modèle afin de permettre l'inhibition des points de contrôle comme une stratégie de combinaison raisonnable avec des médicaments candidats. Nous présentons ici les données de réponse antitumorale dans un modèle de maladie Hepa 1-6 sous-cutanée plus avancée.
Données de réponse du blocage des points de contrôle pour Hepa 1-6
Le début du traitement avec des tumeurs Hepa 1-6 plus avancées (volume tumoral moyen de ~130 mm3) a entraîné une réponse favorable pour le test des médicaments candidats associés à un blocage des points de contrôle. La figure 1 illustre la croissance moyenne (A) et individuelle (B) des tumeurs de contrôle, ainsi que celles traitées par monothérapie anti-mPD-1 ou anti-mPD-L1. À ce volume tumoral de départ accru, chaque monothérapie a entraîné 40 % de réponses complètes durables, ce qui suggère que même si cette stratégie offre certainement un moyen de test de stratégies combinées rationnelles, ce modèle peut encore être optimisé. Nous allons continuer à améliorer ce modèle afin que le blocage des points de contrôle puisse maintenir une réponse modérée, avec, dans l'idéal, moins de réponses complètes. De petites différences dans le volume tumoral moyen peuvent signifier de grandes différences en termes de réponse. C'est pour cette raison que nous abordons systématiquement ce défi par étapes, avec une étude continue sur l'efficacité antitumorale du blocage des points de contrôle avec un début de traitement à un volume tumoral moyen d'environ 150 mm3. L'étude n'est pas encore terminée, mais elle présente déjà une diminution des réponses complètes par rapport aux volumes de tumeurs initiales plus faibles (données non présentées).
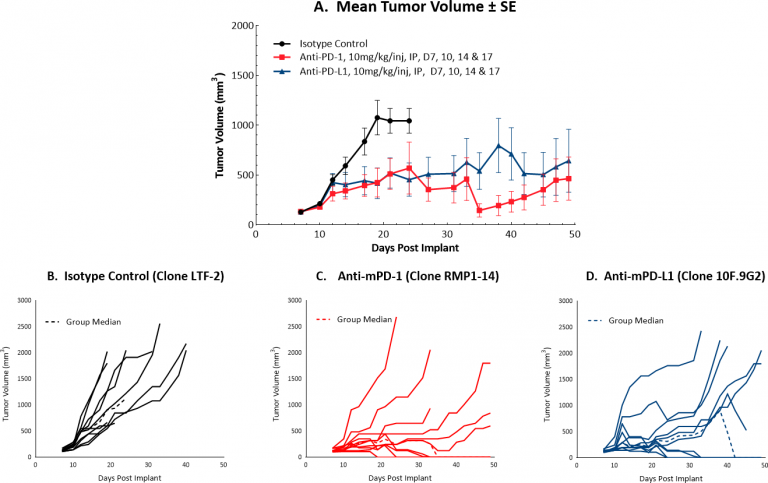
Fig. 1 : réponse à l'inhibition des points de contrôle pour déterminer le stade à 130 mm3
Pour accroître encore davantage l'utilité de ce modèle CHC, nous avons activé par luciférase la lignée cellulaire de Hepa 1-6 (Hepa 1-6-luc). Cette ligne est actuellement optimisée en vue d'être utilisée dans la modélisation orthotopique du cancer du foie. La balise luciférase sera utilisée pour surveiller la croissance tumorale grâce à l'imagerie par bioluminescence (BLI) suite à un implant directement dans le foie.
Conseils d'utilisation du modèle Hepa 1-6 dans votre prochaine étude sur le foie
Le modèle Hepa 1-6 offre des moyens précliniques fiables pour l'étude du carcinome hépatocellulaire. En outre, la forte réponse à l'inhibition du point de contrôle, associée à une analyse de cytométrie en flux, suggère un microenvironnement tumoral peu immunosuppressif. Par conséquent, le modèle Hepa 1-6 peut être considéré comme immunologiquement « chaud ». Ce phénotype immunologiquement favorable est hautement attractif pour les chercheurs qui travaillent au développement d'agents thérapeutiques visant à stimuler le système immunitaire.
Please contact us to speak with our scientists about how Hepa 1-6 or one of our other syngeneic models can be used for your next immuno-oncology study.
Références
2 https://www.cancer.net/cancer-types/liver-cancer/statistics
3 Pinter M & Peck-Radosvljevic M. 2018. Review article: systemic treatment of hepatocellular carcinoma. Aliment Pharmacol Ther. Sep; 48(6): 598–609.
Connexion
Entamons le dialogue
Nous contacter