Auteurs : Sheri Barnes, PhD | Director, Scientific Development &Maryland Franklin, PhD | Vice President, Scientific Development
Date: March 2019
Le cancer colorectal est le quatrième cancer le plus fréquemment diagnostiqué aux États-Unis. Le cancer colorectal représente la troisième cause de décès liés au cancer chez les femmes et la deuxième chez les hommes. En 2019, on estime que plus de 145 000 nouveaux cas de cancer colorectal seront diagnostiqués aux États-Unis et que l'on dénombrera plus de 51 000 décès de patients. Les initiatives de prévention et de détection précoce au cours des dernières décennies, ainsi que les meilleurs traitements proposés, ont permis la baisse du nombre de cancers colorectaux diagnostiqués et du nombre de décès. Ces mesures ont également permis d'augmenter le taux de survie global à cinq ans à 64,9 %, mais la survie chute vertigineusement pour les patients dont le cancer n'est pas détecté précocement.[1] Pour cette raison, le développement de nouveaux traitements pour le cancer colorectal est un besoin permanent.
L'avènement de l'immunothérapie a nécessité des modèles de tumeurs de souris syngéniques à la cinétique de croissance et la réponse aux agents immunomodulateurs adaptées pour faire progresser le développement des traitements immuno-oncologiques. L'un de ces modèles d'adénocarcinome du colon, MC38, a été caractérisé par Labcorp pour permettre le développement de ces agents. MC38 a été isolé d'une tumeur du côlon chez une souris C57BL/6 après une exposition de longue durée à l'agent cancérigène DMH (1,2-dimethylhydrazine dihydrochloride) [2]. Comme décrit ci-dessous, MC38 présente un profil de réponse favorable aux anticorps immunomodulateurs suggérant un microenvironnement tumoral modifiable par l'activation immunitaire. Par conséquent, MC38 dispose de tous les atouts pour devenir un puissant modèle en immuno-oncologie, très utile dans le développement de médicaments.
Tumeurs MC38 après thérapie par inhibition des points de contrôle
Le temps de doublement in vivo des tumeurs MC38 sous-cutanées est d'environ 4 jours, un taux de croissance modéré qui peut offrir une fenêtre de dosage allant jusqu'à trois semaines pour les agents testés afin de susciter leur activité anti-tumorale. Le modèle a été utilisé dans une étude pour évaluer la réponse aux anticorps inhibiteurs de point de contrôle fréquemment utilisés. La figure 1 montre les volumes tumoraux moyens (A) et les volumes tumoraux individuels (B-F) des tumeurs témoins non traitées par rapport à celles traitées avec témoin d'isotype, anti-mCTLA-4, anti-mPD-L1 ou anti-mPD-1. Le dosage de tous les agents testés a commencé une fois les tumeurs établies (environ 100 mm3). Les anti-mPD-L1 et anti-mPD-1 ont montré les activités anti-tumorales les plus significatives, parmi les trois inhibiteurs de point de contrôle, avec environ 6 et 8 jours de retard de croissance tumorale au jour 22, 40 % et 50 % de répondeurs présumés, et un temps de progression plus long de 32 et 29 jours, respectivement, par rapport au groupe témoin non traité. Il est évident que ces traitements suscitent des améliorations supplémentaires ou synergiques lorsqu'ils sont associés à des molécules candidates.
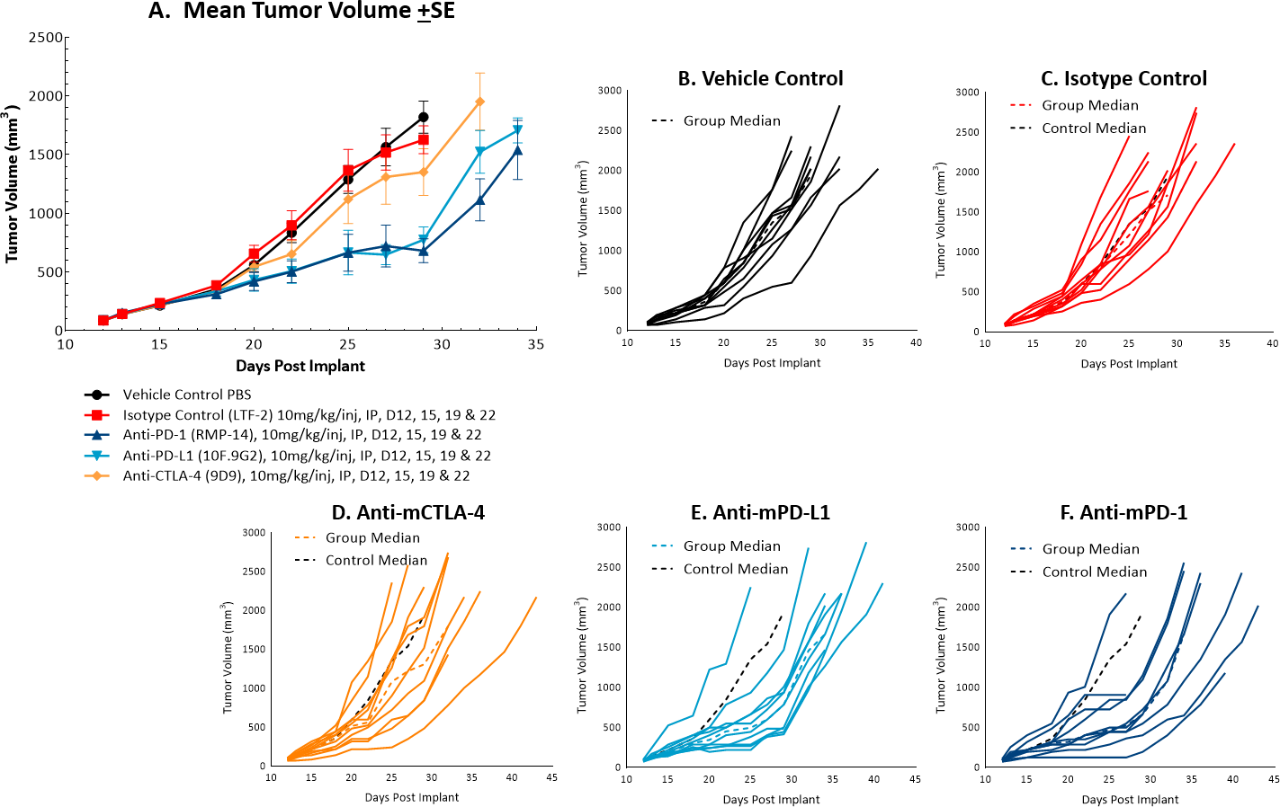
Fig. 1 : croissance moyenne et individuelle des tumeurs MC38 après thérapie par inhibition des points de contrôle.
Tumeurs MC38 après thérapie par anticorps costimulateurs
La réponse de MC38 aux molécules costimulatrices anti-mOX40 et anti-mGITR a également été évaluée et nous avons constaté une activité anti-tumorale moins importante par rapport aux réponses illustrées dans la figure 1 (voir les figures 2A et 2B-E). Le traitement anti-mOX40 a produit une activité anti-tumorale modérée avec un ΔT/ΔC médian de 51 % au jour 22, 10 % de répondeurs présumés et 4,5 jours de retard de croissance de la tumeur. Le traitement par anti-mGITR a eu la plus faible activité anti-tumorale avec un ΔT/ΔC médian de 72 % au jour 22, 20 % de répondeurs présumés et 2 jours de retard de croissance de la tumeur. Toutefois, ces agents présentent également des signes d'activité montrant qu'ils peuvent être améliorés, ce qui fait de MC38 un modèle intéressant pour les thérapies combinées avec un large éventail d'agents immunomodulateurs.
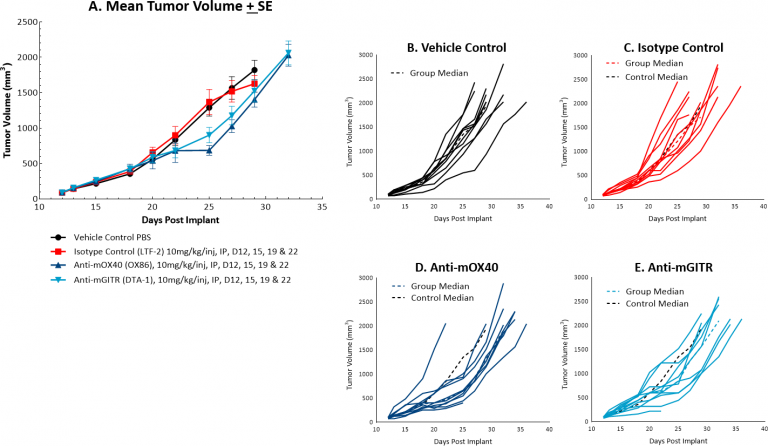
Fig. 2 : croissance moyenne et individuelle des tumeurs MC38 après thérapie par anticorps costimulateurs.
Tumeurs MC38 après radiothérapie ciblée seule ou combinée à des anticorps Anti-mPD-1
Bien que la radiothérapie ne soit pas couramment utilisée dans le cancer du côlon, on peut y avoir recours dans certaines circonstances, par exemple pour tenter de réduire une tumeur avant l'opération ou en combinaison avec la chimiothérapie chez les patients qui ne sont peut-être pas en assez bonne santé pour l'opération. Cependant, en comparaison, les rayons sont utilisés plus fréquemment dans le cancer rectal. We utilize the Small Animal Radiation Research Platform (SARRP, Xstrahl) to deliver focal beam radiation to murine models. Dans le modèle MC38 sous-cutané, nous avons testé une dose unique ciblée de 5, 10 ou 20 Gy. Nous avons observé une activité anti-tumorale en réponse à la dose après le traitement (figure 3), 5 Gy fournissant une très faible activité, 10 Gy fournissant une activité modeste, et 20 Gy fournissant une activité substantielle. Dans nos travaux ultérieurs, nous avons testé la combinaison de l'irradiation à 10 Gy et de l'anticorps anti-MPD-1 dans le modèle de tumeur MC38 (figure 4). Nous avons constaté que la combinaison entraînait une amélioration des réponses anti-tumorales et permettait d'obtenir 30 % de survivants sans tumeur alors que les monothérapies n'avaient pas de survivants sans tumeur. MC38 est donc également un modèle intéressant pour tester des approches combinées avec la radiothérapie.
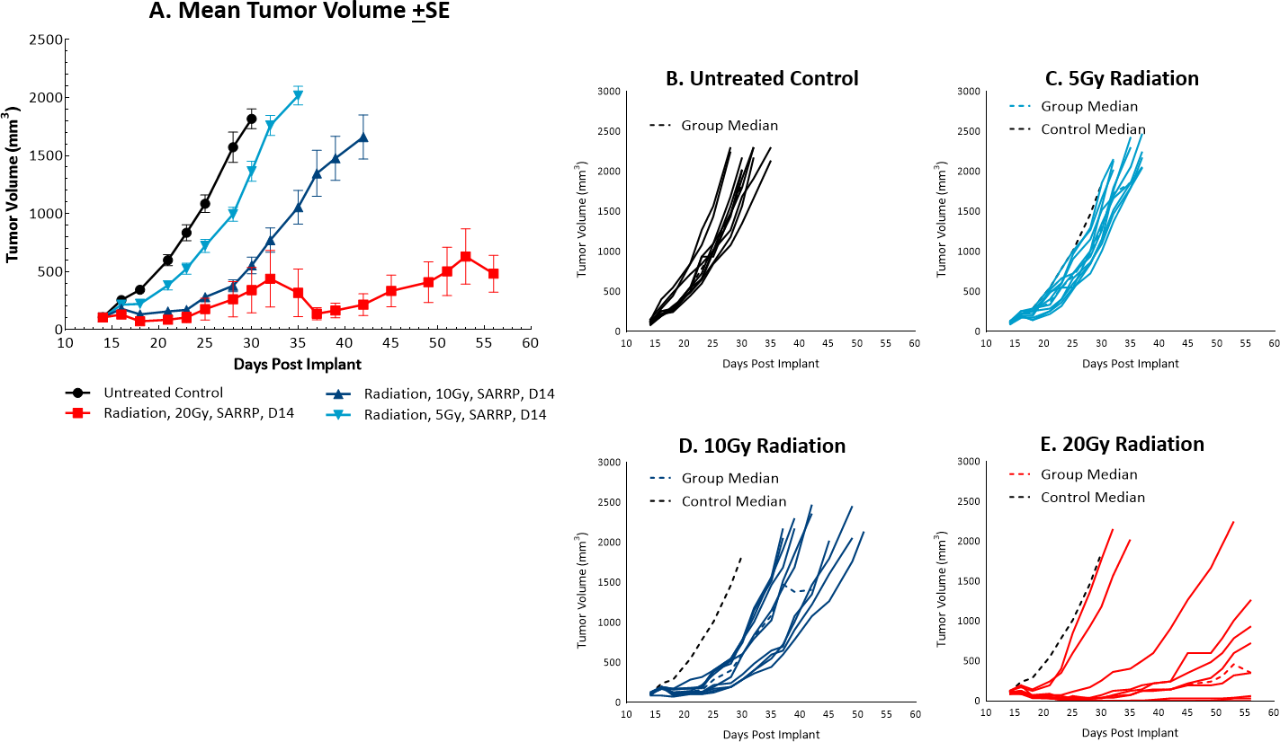
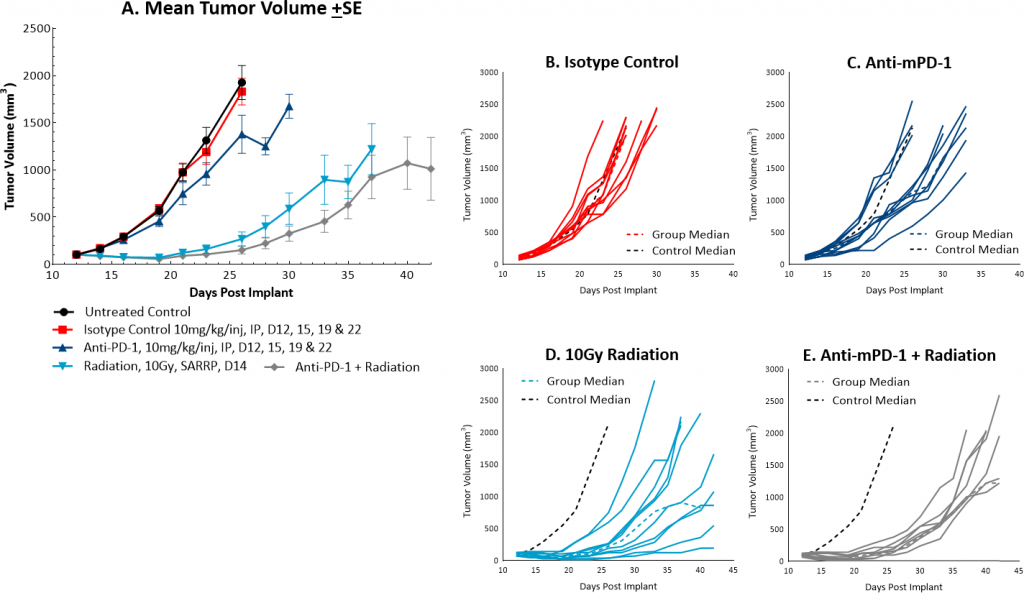
Fig. 4 : croissance moyenne et individuelle des tumeurs MC38 après traitement combinant anti-mPD-1 et radiothérapie focale.
Le modèle de carcinome du colon murin MC38 peut être utilisé en tant que modèle d'immuno-oncologie préclinique fiable. Nos données sont en faveur de l'utilisation de cet outil dans la recherche de nouvelles combinaisons de traitements par inhibiteurs de points de contrôle, molécules costimulatrices ou autres approches innovantes.
Please contact us to speak with our scientists about how MC38 or one of our other syngeneic models can be used for your next immuno-oncology study.
Références
[2]Corbett T.H., Griswold Jr, D.P., Roberts J.C., Peckham J.C., Schabel, Jr, F.M. (1975) Tumor induction relationships in development of transplantable cancers of the colon in mice for chemotherapy assays, with a note on carcinogen structure. Cancer Research, 35: 2434-2439.
Connexion
Entamons le dialogue
Nous contacter